contents
1. SIRH7/LDOC1
(1) 調和のとれた構造が適切な時間を刻む
Sirh7/Ldoc1は胎盤を構成する各種胎盤細胞の発生分化・成熟に関係するため、ノックアウト(KO)マウスでは胎盤の三層構造(ラビリンス層、スポンジオトロホブラスト層、巨大トロホブラスト層からなる)に乱れが生じる(図1左下)。これらの細胞は様々な胎盤ホルモンを産生に関わるため、KOマウスでは内分泌機能に異常を生じる37。胎盤ホルモンには、TGC細胞(trophoblast giant cells)が産生するP4やプラセンタルラクトーゲン1(PL1)、PL2、各種スポンジオトロホブラスト細胞が産生する20種類以上のプロラクチン様タンパク質などがある。
KOマウス胎盤では、これらの発現量やタイミングに変化をきたし、妊娠維持・出産のタイミングの異常が起きる37。通常、出産前日の18.5日目には血中P4濃度はほぼ0に落ち、これが出産の引き金になる。しかし、KOマウスでは胎盤でのP4の過剰合成が起きるため、約半数の母親マウスが18.5日の時点でP4値が低下しきらず(図1右下)、出産が1〜2日の遅延する。出産で疲弊し子育てに影響がでるため、離乳産仔数は野生型の5.8匹に比べて1.7匹に低下する。このようにSirh7/Ldoc1は、胎盤の内分泌機能の制御を介して妊娠維持や分娩時期の制御に重要な機能をはたすことが明らかとなった。
真獣類では、胎盤の形態の違いにかかわらず、胎盤の構成細胞が種々の内分泌ホルモンを産生していると考えられることから、妊娠維持や分娩の時期の決定に各種胎盤細胞の分化・成熟のバランスを取ることの重要性は変わらない。Sirh7/Ldoc1は出産に向けてちょうどよい時間を刻む胎盤を支える遺伝子として進化の過程で選択されたのであろう。マウス胎盤のきれいな三層構造が、各種の胎盤ホルモンの分泌を介して妊娠・出産のタイミングを決めているということは、 “胎盤の整った構造が妊娠に適切な時間を刻む” ことを意味しているだろう。
(2) 齧歯類の胎盤でP4産生が起きる意味
P4は妊娠維持に必須のホルモンとして知られ、血中P4濃度を保ことが妊娠のために重要であるという点は真獣類で共通している。ヒトでは初期には卵巣がP4を産生し、後期では胎盤が産生を担っている。一方でマウスなどの齧歯類では一貫して卵巣がP4産生をすると長らく信じられていた1。実際、妊娠マウスにおいては卵巣除去後すぐに流産が誘発されるが、P4の腹腔内投与でそれは完全に回避される。妊娠成立後の卵巣でのP4産生維持には、胎盤ら分泌されるPL1とPL2が機能する。妊娠10日目にPL1からPL2への発現の切り替えが起きる時、一時的に卵巣P4産生が低下し、血中P4濃度も著しく低下する2(図13右)。なぜこの時、流産が起きないのか内分泌学上の長年の疑問であった。
私たちはSirh7/Ldoc1 KOマウスの解析過程で、この時期のマウス胎盤に一過性のP4産生があることを明らかにした37(図1右下)。この胎盤における一時的かつ局所的なP4産生には、血中P4濃度が低下した状況で母体免疫系から胎仔・胎盤を直接守る重要な働きがあると考えている。マウス胎盤でP4が産生される可能性は1970年代から示唆されていたが、充分なP4量が検出されないため、その存在や生理的な意義についてはこれまで全く無視されてきた。しかし、今回、私たちが開発したP4測定法で測定すると、胎盤でも卵巣に匹敵する産生量が確認でき、初めてマウス胎盤でのP4産生を実証できた37。
近年、ネコの胎盤においてもP4産生の可能性が示唆され、また、P4産生はないとされているラクダや他の動物の胎盤にもP4合成酵素 (Hsd3b)をコードする遺伝子の発現が確認されており、これらの動物の胎盤においてもP4産生が実証される可能性は高いと考えられる。胎盤におけるP4産生は多くの真獣類に共通した現象として考え直す必要があるかもしれない。
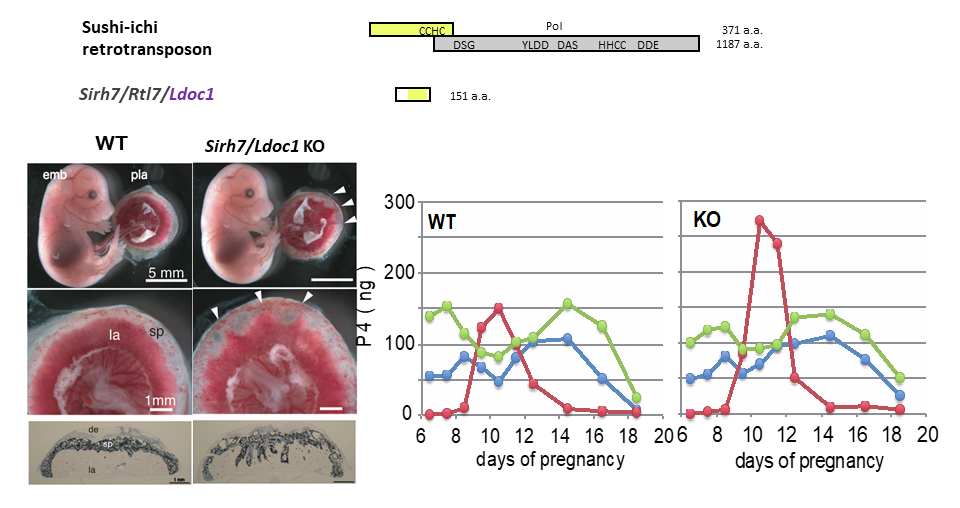
上:スシイチレトロトランスポゾンGag, Polタンパク質とマウスSirh3 タンパク質の比較
左下:胎児と胎盤 (胎盤構造の乱れ)、右下:卵巣と胎盤の P4産生量(緑と赤)と血中P4濃度(青)
出典(研究紹介 文献37)
- Naruse M et al. Sirh7/Ldoc1 knockout mice exhibit placental P4 overproduction and delayed parturition. Development. 141, 4763-4771 (2014).
参考文献
- Malassine A, Frendo J-L and Evain-Brion D. A comparison of placental development and endocrine functions between the human and mouse model. Hum Reprod Update 9, 531-539 (2003).
- Virgo B B and Bellward G D. Serum progesterone levels in the pregnant and postpartum laboratory mouse. Endocrinol 95, 1486-1490 (1974).
2. SIRH11/ZCCCH16
(1) Sirh11/Zcchc16 KOマウスの行動異常
マウスのSirh遺伝子のなかで、Sirh11/Zcchc16 (Rtl4)だけは胎盤での発現を示さない。胎児期から成体期まで主とした発現臓器は脳である38。KOマウスは致死性や成長異常は示さないが、他のマウスにはない行動異常を示す。
飼育していて気づいたのはルーチンに繰り返されることに対して慣れを示さないことである。普通は飼育しているうちに慣れてきて、状態チェックやケージ交換が楽になるのだが、Sirh11KOマウスは毎回騒いでいる。出産後の♀では、飼育者の気配に敏感でケージ内を動き回って新生仔から離れてしまい、なかなかもとの状態に戻れないため、繁殖時にはケージに近寄らないように気を使う。
この性質は行動試験をするとより明らかになった。5日間の活動性テストで、通常のマウスは次第に新しい環境に慣れ、夜間に入って活動性が上がるその度合いは、日を追って低下してくる。しかしKOマウス♂は、同じように繰り返される明暗サイクルに慣れずに、常に初日と同じように反応して高い活動性を示した( 図2A)。
Y字迷路の実験では、コントロール群に比べて空間作業記憶(ワーキングメモリー)が低下していたが、Y字迷路から飛び出してしまい、実験不能となる個体が複数存在した(これらは実験結果には含めていない)。
明暗箱試験では暗箱から明箱に出て行くのに躊躇する時間を測定するのだが、さっさと明箱に出ていく(図2B)。
このようなKOマウスの落ち着きのなさに脳内ホルモン等の異常を考え、マイクロダイアリシス法で大脳前頭葉前部皮質のモノアミン量を測定したところ、ノルアドレナリンを一度完全に放出させた後の回復度に低下が見られた(図2C)。
ノルアドレナリンは延髄や青斑核(脳幹の橋(pons)に存在)にあるノルアドレナリン作動性神経細胞群から、大脳を含め脳全領域に投射され、中枢神経ノルアドレナリンは覚醒-睡眠やストレス、注意、記憶や学習に関係する。今回、新規の環境に慣れないように見えた行動異常も、ノルアドレナリン量の不足が原因で、新しい経験から新しい神経細胞ネットワークを再構成する過程に障害があり、新しい環境に慣れないため3とも考えられる。
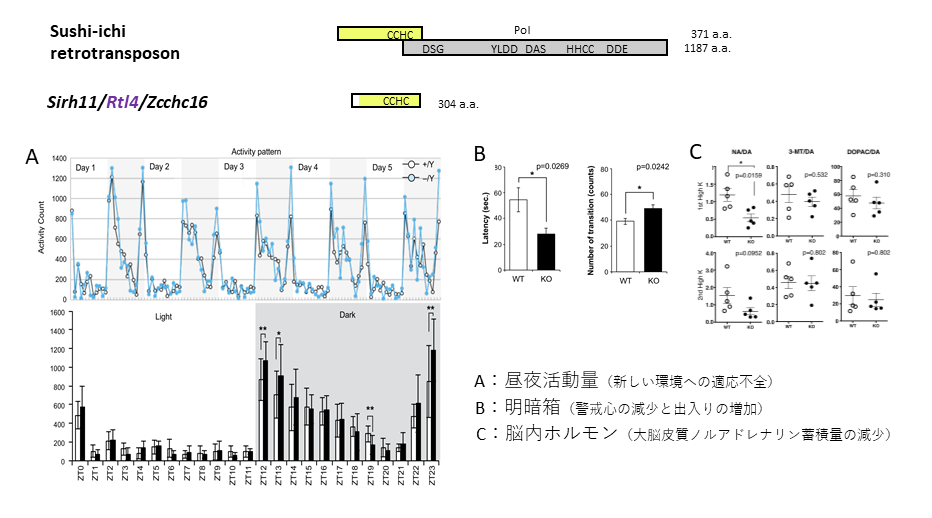
上:スシイチレトロトランスポゾンGag, Polタンパク質とマウスSirh11 タンパク質の比較
下:A, 活動量変化、 B, 明暗箱試験、C, 脳内ホルモン量の変化
出典(研究紹介 文献38)
- Irie M et al. Cognitive function related to the Sirh11/Zcchc16 gene acquired from an LTR retrotransposon in eutherians. PLoS Genet 11(9):e1005521 (2015).
参考文献
- Bouret S and Sara S J. Network reset: A simplified overarching theory of locus coeruleus noradrenaline function. Trends Neurosci. 28, 574–582 (2005).
(2) 真獣類の多様化との関係
SIRH11遺伝子の興味深い点は、獲得遺伝子として機能をもったあと、真獣類のいくつかの系統で大きな変化を起こし、真獣類の多様性に関係した可能性があることである。この遺伝子が哺乳類の進化の過程で真獣類の共通祖先で獲得されたことは、単孔類、有袋類には存在しないという、哺乳類における分布状態から明らかである(図3)。また、真獣類の各種における詳細な比較ゲノム配列解析から、各ゲノム内での遺伝子の存在位置が全て共通であることも確認できている。
一方、多様性に関して、真獣類の中の南アメリカ大陸で進化した異節類 (Xenarthra) に属するアルマジロ、ナマケモノでは、多重のナンセンス変異とフレームシフトによりSIRH11遺伝子のタンパク質構造が完全に破壊されている(図4)。はじめに異節類の共通祖先でC末のCCHC RNA結合ドメインの上流にstop変異が入り(赤枠で囲った青色の星印)、遺伝子機能を失って偽遺伝子化した後、さらに多くのstop変異(赤色の星印)が蓄積したと考えられる。
ヒトとマウスでは完全長のSIRH11タンパク質が保存されているが、この2種が含まれる真主齧獣類(Euarchontoglires)やウマ・ブタなどを含むローラシア獣類(Laurasiatheria)などでも、いくつかの系統で、SIRH11タンパク質の大きな欠失が見られる。これにはN末側半分の欠失、C末のCCHC RNA結合ドメインの欠失、の2つのタイプがある( 図5)。
2タイプの欠失について霊長類に関する例を紹介する。京都大学霊長類研究所 古賀章彦先生との共同研究で行った霊長類に関する研究では、南アメリカに生息する新世界ザル(広鼻猿類)に属する種では、調べた6種全てでN末側にstop 変異が入っている。この変異DNA配列からは、次のATGから読まれたとしてN末側の約半分が欠失した短縮型SIRH11タンパク質が読まれると推定され、タンパク質の機能が大きく変化した可能性が示唆された。
一方、ヒトなどが属する旧世界ザル(狭鼻猿類)のヒト上科グループにおいて、大型猿類であるヒト・チンパンジー・ゴリラ間ではSIRH11遺伝子は進化的に強く保存されている。しかし、同じくヒト上科のテナガザル科に属する1種ではCCHC RNA結合ドメインの欠失が見られ、他の2種では遺伝子自体の欠失が起きていた。すなわちテナガザル科ではこの遺伝子の機能喪失が起きていると考えられる。
霊長類の進化という観点から見ると、新世界ザルはアフリカから南アメリカに漂着した共通祖先に由来する4.5。アジアに起源をもつ旧世界ザルは、ヒト上科に属するヒト・チンパンジー・ゴリラの共通祖先がアジアからアフリカに移動したと考えられるのに対し、テナガザルはアジアに残った祖先に由来すると考えられている6。つまり、SIRH11遺伝子は、南アメリカの新世界ザルとアジアに残った旧世界ザルでは機能を失うか、大きく変化し、アフリカへ移動した旧世界ザルでは強く残っていると推測される。
SIRH11は(1)で述べたように、新規の環境に慣れるための機能を有する遺伝子であり、哺乳類の行動進化に重要な役割を果たしたと考えられる。真獣類の中でのSIRH11の遺伝子変異の多様性は、行動の多様性を反映しているのかもしれない。異節類やテナガザルの例は、生息環境によってはSIRH11遺伝子の機能が変化した、または失った方が有利であるという状況が存在した可能性を示唆している。ダーウィンの進化論では “突然変異” と “環境による選択” が進化を駆動力の2大要素とされている。将来、SIRH11遺伝子が、この2つの要素の相互作用による進化を実証する良いモデル系となると期待している。
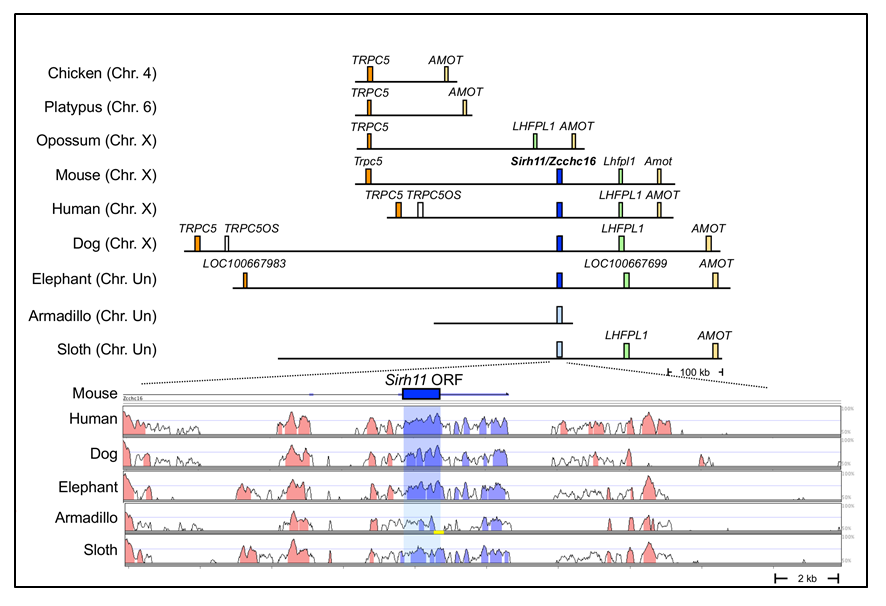


真主齧獣類: Euarchontoglires, ローラシア獣類:Laurasiatheria, アフリカ獣類: Afrotheria
紫色のバーはCCHC RNA結合ドメインを示す。
出典
- Irie M, Koga A, Kaneko-Ishino T* and Ishino F*. An LTR retrotransposon-derived gene displays lineage-specific structural and putative species-specific functional variations in eutherians. Front Chem 4:26 (2016).
参考文献
- Houle A. The origin of platyrrhines: an evaluation of the Antarctic scenario and the floating island model. Am J Phys Anthropol 109, 541–559 (1999).
- Poux C, Chevret P, Huchon D, de Jong W W and Douzery E J P. Arrival and diversification of caviomorph rodents and platyrrhine primates in South America Syst Biol 55, 228–244 (2006).
- Springer M S, Meredith R W, Gatesy J, Emerling C A, Park J, Rabosky D L, Stadler T, Steiner C, Ryder O A, Janečka J E, Fisher C A and Murphy W J. Macroevolutionary dynamics and historical biogeography of primate diversification inferred from a species supermatrix. PLoS ONE 7:e49521 (2012).
3. なぜ、哺乳類特異的獲得遺伝子群 SIRH/RTLはX染色体に多く存在するのか?
SIRH 遺伝子群11個のうち インプリント遺伝子であるPEG10・PEG11とSIRH3の3つは常染色体上に、残りの8個 SIRH4-11はすべてX染色体上に存在する。この偏りに意味はあるのだろうか?感染の結果、ウイルスのような外来由来のDNAはどの染色体にもランダムの飛び込む可能性がある。飛び込んだ当初は、宿主の遺伝子を破壊したり、遺伝子発現系を乱したりするなど害を与えるだろう。この場合、宿主は死亡するか、飛び込んだDNAをメチル化で不活化して生き延びるかになる。
しかし、どちらの場合でも、体細胞にだけ感染した場合には子孫に外来DNAは伝わらないので新しい遺伝子にはならない。遺伝子として残るためには、生殖細胞から次世代に伝わっていくことが必要である。
生殖細胞ゲノムへのウイルス由来DNA配列の挿入に関しては、以下のような可能性が考えられる。初めて出会うウイルスのアタックで多くの個体が死亡するが、生き延びた♂の中にはウイルスを精巣の中にもっている個体がいる(エボラ出血熱 WHO 2017年5月報告資料参照)。この♂と健康な♀が交配することで、受精卵にウイルスが入り込んで次世代のゲノムに伝わる可能性がある。他にも妊娠中の♀が感染した場合には胎盤、羊水、胎児でウイルスが存続することから(参考資料 参照)、胎児(の生殖細胞)に伝わる可能性はある。
現在、オーストラリアではコアラへのレトロウイルス感染が拡大しており、多くの個体が死亡している、しかし、生き延びた個体の子孫のゲノムにはレトロウイルスが内在化しており、メンデル遺伝様式で子孫に伝わっている事も確認されている7。生殖細胞ゲノムへのレトロウイルスの挿入は“極めて稀なことではない”のかもしれない。
次に、常染色体へ挿入した場合とX染色体への挿入の場合を有害性から比較して、その後の展開の違いを考えてみる。哺乳類では性染色体がXXの♀とXYの♂におけるX染色体上の遺伝子数のバランスをとるために、♀のX染色体の1つがランダムに不活性化されている。このX染色体不活性化がX染色体に外来の遺伝子の集中を生み出しているのではないか?というのが我々の仮説である。生殖細胞に飛び込んだウイルス由来のDNAが当初、非常に有害(harmful)であると仮定する。
- 常染色体に飛び込んだ場合は、DNAメチル化や変異で対応することになる。ウイルス由来のDNAが伝わった子孫個体の大部分は致死(優性阻害 ドミナントネガティブ)となる(図6A)が、うまくDNAメチル化で不活性化できた場合には生存できる可能性が出てくる。
発現しないDNAは中立説の遺伝的浮動(ランダムドリフト)の原理に従い、集団内に固定される可能性が生じる。
長い間には変異が多く蓄積してウイルス由来のDNAを無害化できれば、新たに遺伝子として使える可能性は生じる。しかし、発現せず選択圧がかからないDNAから、個体発生に有利な遺伝子ができる可能性は低く、ゲノムの中に残骸として残るだけになるだろう。実際、ヒトゲノムの大部分はそのような残骸である。 - X染色体に飛び込んだ場合、基本的には(1)と同じ状況が進むことが考えられる。すなわちX染色体が1本しかない♂はもちろん、大部分の♀も死亡する。
しかし、X染色体不活性化の効果により、以下のようにわずかな♀は生き残る可能性が生じる。
- X染色体不活性化による生存♀XX出現期
♀の場合、飛び込んだX染色体(変異型X染色体、以下Xと表記)側がX染色体不活性化を受ければ毒性は薄められる。不活性化はランダムに起こるので、トータルではXの不活性化の割合は50%である。しかし、体の組織のなかでは、Xが不活性化された細胞が集まった場所、またはその逆に正常X染色体(X)がより不活性化された場所が生じる可能性がある。
前者の場合、生死に関わるような有害性が軽減され(非常に有害⇒有害)、♀XXがわずかながら出現し、子孫を残す可能性が出てくる(図6B)。 - 正常♂との交配を繰り返す♀XX低レベル維持期
まだ毒性が強い段階では、XX × XY で生まれる子の性染色体の伝わり方は ♂XYと XY、♀XXと XX。このうち♂XYは死亡し、XYには外来DNAはゲノムに無いので、外来DNAはオス由来では伝わらない。ほとんどの♀XXもこの段階では死亡するが、1) で説明したようにX染色体の不活性化により一部の♀XXが生存できるようになると、交配は♂XYと♀XX、XX(ただしXX<<XX)で行われ、次世代の子は♂XY、♀♀XXとXX(♂XYと多くの♀XXは死亡)となり、同じ状況が繰り返される。常に正常の♂XYとの交配になるため、集団全体の中のXの割合は低い(図6C)。 - 外来DNAの変異とX染色体不活性化の相乗効果による♀XX微増期
外来DNAの変異により毒性が下がると、♀XX<XXとなり、集団に占める♀XXの割合が少し増えてくる。子は ♂XY、♀XX<XXで、♂XYと多くの♀XXはまだ死亡。 - 生存♂XY出現と♀XX増加期
毒性がさらに弱くなるとX染色体不活性化によらず生存する♀XX(Xは生存可能な変異型X染色体を示す)が出現し、♂XYも生存する可能性が出てくるため、♂XYとXY(XY<XY)と♀XXとXX(XX≦XX)間の交配となり、集団内にX染色体がふつうに存在するようになる(図6D)。 - Xの集団への固定期
外来DNAの変異によりXがXよりもわずかに有利になる状況(XY>XY, XX≧XX)では、集団内のXの割合は増加し、最終的にはXが集団内に固定化される(ダーウィン進化)。こうして♂XY、♀XX(図6D右下の個体)の状況が出現する(外来DNAの獲得遺伝子化完了)。
すなわち、不活性化の機構があるX染色体は “活かしたまま” 外来DNAと共存しやすい環境であり、しかも、外来DNAが選択圧を受けることで生存に有利な変異が選択される状況が生じる。このように、外来DNAに対してメチル化や変異でしか対抗できない常染色体より、X染色体に獲得遺伝子が集まりやすいことが説明できるのではないか?
哺乳類には哺乳類特異的獲得遺伝子として、SIRH遺伝子群以外にもう一つPNMA遺伝子群が、存在しているが、その内訳は19個中11個がX染色体上に存在する(ただし遺伝子重複をした(と考えられる)ものは元と合わせて1つと数えると7/12)。
X染色体不活性化は2つのXのうちどちらを不活性化するかはランダムである。インプリンティングは片親性発現となる染色体が決まっているが、どちらの機構も片親性発現となる点は同じである。そう考えると、SIRH 遺伝子群11個の中で10個が片親性発現遺伝子ということになる(PEG10、PEG11はゲノムインプリンティングで制御され、SIRH4-11の8個はX染色体不活性化でコントロールされる)。唯一、SIRH3だけが例外で、常染色体上にありインプリント遺伝子でもない。このSIRH3には片親性発現を介さない遺伝子への道があるようだが、それはまた別のお話し・・・。
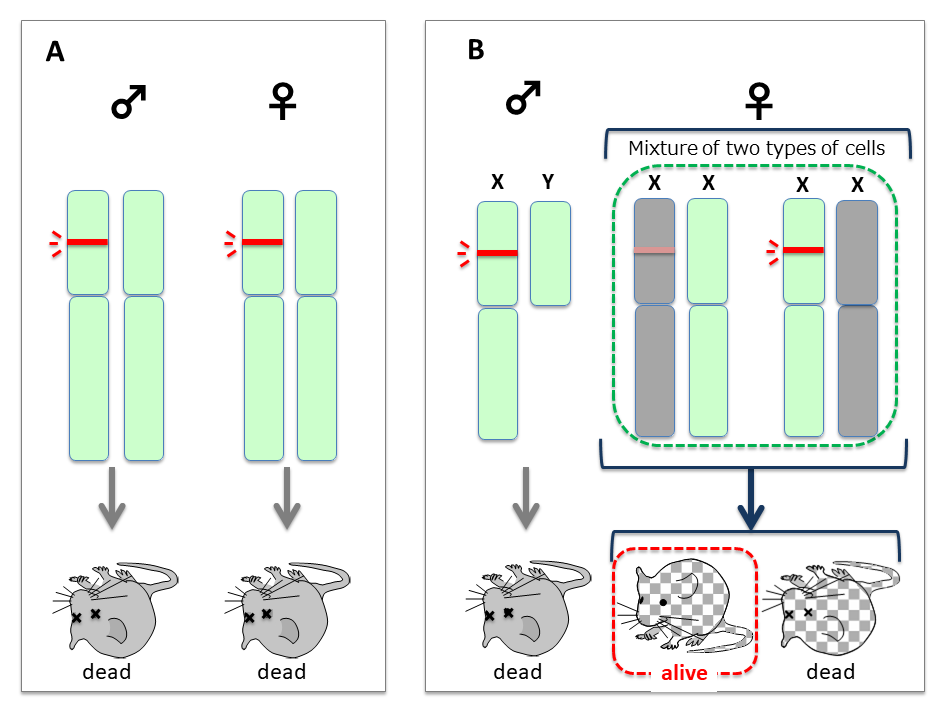
赤いバーはレトロウイルス由来のDNAの挿入部位を示す。X染色体不活性化(灰色)では挿入DNAの発現も起こらないため、メスの一部は生き残る可能性が生じる(赤点線枠)。1) X染色体不活性化による生存♀XX出現期 に対応
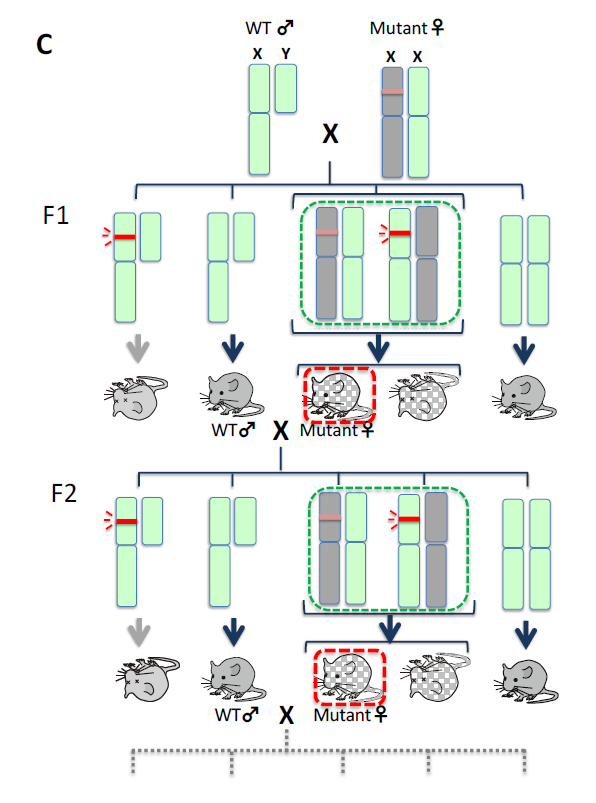
一本のX染色体に外来DNAの挿入を持つメス(ヘテロメス)と正常オスの交配により、一部のメス(ヘテロメス)に外来DNAは遺伝する(赤点線枠)。
一方、外来DNAを持つオスはすべて死亡するため、外来遺伝子はメスを通じてしか伝わらない。2) 正常♂との交配を繰り返す♀XX低レベル維持期に対応
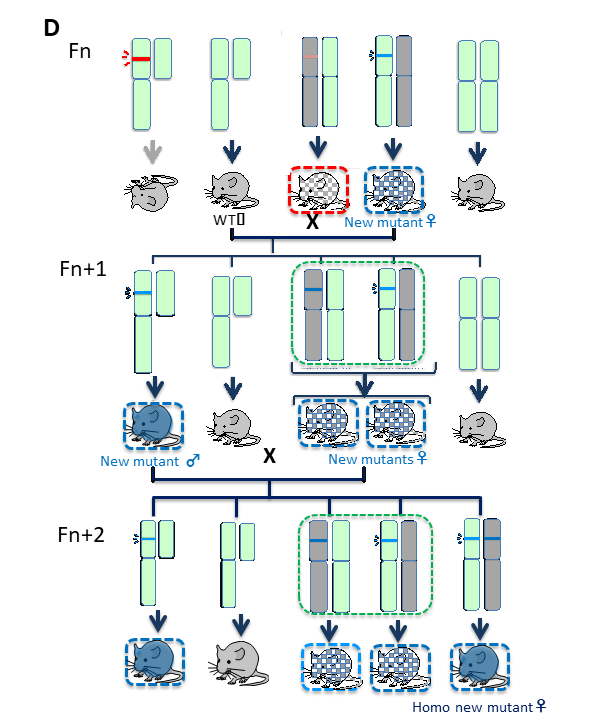
Fn世代で外来DNAが変異により致死性を(青線)失うメス個体(薄青点線枠)が出現すると、Fn+1世代に挿入を持つ生存オス(青点線枠)が出現する。この新しい変異を持つメス(ヘテロメス)との交配により、ホモメス(青点線枠)も生まれる(Fn+2世代)。これを繰り返すことで外来DNAは次第に集団内に広がり内在遺伝子化を始める。4) 生存♂XY出現と♀XX増加期に対応
出典
- Kaneko-Ishino T, Irie M and Ishino F. Mammalian-specific traits generated by LTR retrotransposon-derived SIRH genes. In Evolutionary Biology: Self/NonSelf Evolution, Species and Complex Traits Evolution, Methods and Concepts (ed. Pontarotti P), Springer International Publishing, pp.129-145 (2017).
参考文献
- Tarlinton R E, Meers Joanne and Young P R. Retroviral invasion of the koala genome. Nature 442, 79-81 (2006).
参考資料
厚生労働省検疫所 FORTH エボラ出血熱について(ファクトシート)2018年1月 WHOより引用
- 性行為感染
性行為感染のリスク、特に、時間の経過とともに精液中で活性があるため、感染力を有するウイルスの存在率について、さらに多くの調査データと研究(成果)が必要とされています。 - エボラ出血熱から回復者に潜伏するウイルス
エボラウイルスは、エボラ出血熱からの回復した一部の人の免疫特異部位で存続することが知られています。これらの部位には、睾丸、眼の内部、および中枢神経系などがあります。妊娠中に感染した女性では、胎盤、羊水、胎児でウイルスが存続します。授乳中に感染した女性では、ウイルスは母乳中で存続する可能性があります。 - ウイルスの存続についての研究では、病気からの回復者の何人かの体液では、逆転写酵素ポリメラーゼ連鎖反応(RT-PCR)法検査において、エボラウイルスが9か月以上にわたって陽性であったことが示されています。
4. LTRレトロトランスポゾン、レトロウイルスからの獲得遺伝子による哺乳類の進化
ゲノムインプリンティング研究で発見したPEG10、PEG11とこれらを元にしてスクリーニングで同定したSIRH3-11遺伝子(これらは現在RTL遺伝子群と呼ばれる)は、sushi-ichiレトロトランスポゾンというLTRレトロトランスポゾンに、現時点では最も高い相同性を示す。とは言え、どの遺伝子もアミノ酸配列レベルで20~30 %の相同性を示すだけであり、直接、これに由来したのかどうかは確かではない。
獲得遺伝子として感染により哺乳類の祖先のゲノムに入り込んだと考えると、過去にsushi-ichiレトロトランスポゾンによく似たレトロウイルスが存在し、それに由来した可能性が高いと考えている(Headline 6参照)。
LTRレトロトランスポゾンとレトロウイルスは構造が似ており、違いはウイルスがGagとPolに加えて感染に必要なEnv遺伝子を持っていることである(図7)。
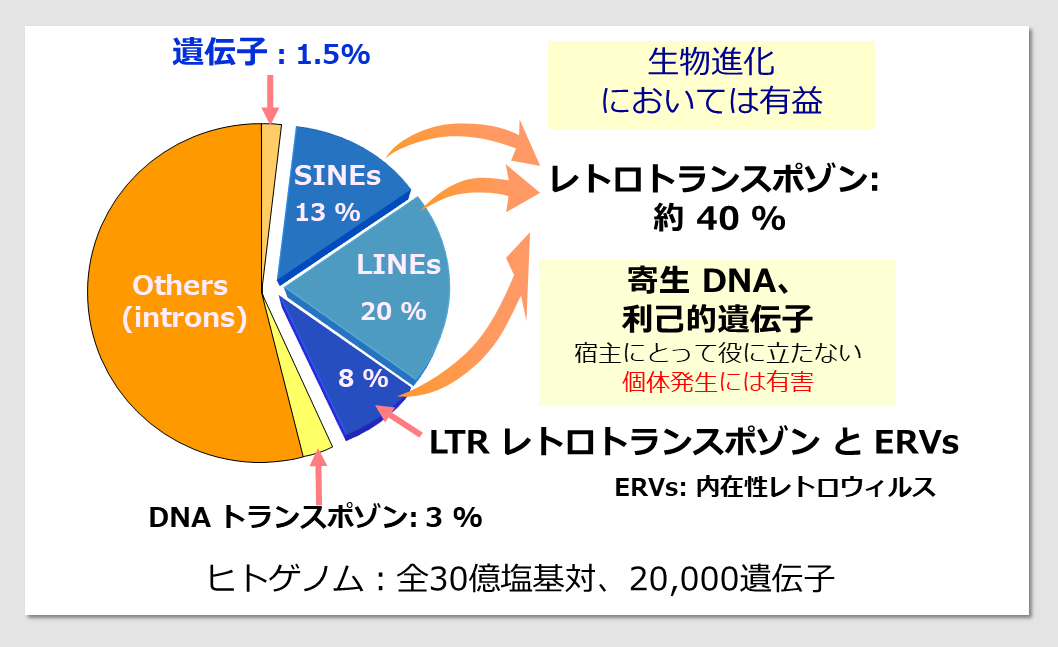
ヒトゲノムではタンパク質をコードする遺伝子は1.5 %を占めるのに対し、LTRレトロトランスポゾンと内在性レトロウイルス(ERV)を合わせたグループは8 %を占める。SINEとLINEを加えたレトロトランスポゾン全体では全ゲノムの約半分を占めており、これらはかつては無駄なものであり、ゲノム中のゴミと考えられていた(図8)。
しかし、我々は少なくともLTRレトロトランスポゾン/内在性レトロウイルスの一部は、哺乳類の個体発生に必須な内在性遺伝子として重要な機能を果たしていることを明らかにし、それを獲得遺伝子と呼んでいる。
このようなレトロトランスポゾンやDNAトランスポゾンなどからの遺伝子獲得は、生物界では幾つか見つかっている。
例えば真核生物の持つテロメラーゼは、LTRレトロトランスポゾン/レトロウイルスのPolにコードされる逆転写酵素(reverse transcriptase, RT)8に、脊椎動物の免疫グロブリンクラススイッチに関与するRIG1, 2遺伝子はDNAトランスポゾンのトランスポザーゼ9,10に、由来すると考えらえている。また、植物の光合成に必要な遺伝子のいくつかもDNAトランスポゾン由来11-13と考えられている。
このように、生物にとって重要な機能に関わる遺伝子のいくつかは獲得遺伝子に由来しているが、その例はきわめて限られていた。しかし、哺乳類の成立の際に、SIRH遺伝子群だけでも11個が獲得されたように、集中して遺伝子獲得が起きており、 “レトロトランスポゾン/ウイルスからの遺伝子獲得”は、哺乳類という生物群の成立を考える上で重要な意味を持つと考えられる。
哺乳類はその誕生後、約1億年後に大規模な適応放散を起こし、現在の繁栄へとつながった。これは6千5百万年前(65 Ma)におきた隕石の衝突を原因とする白亜紀—古第三紀(K-Pg)境界(図9参照)の大絶滅後に、鳥類の祖先となる系統の恐竜以外は絶滅し、地球上に大きく空いたニッチに、真獣類も有袋類も多様な進化を遂げた種が分岐していったためである。
この時期にはレトロウイルスの感染に必要なEnv遺伝子が、哺乳類の系統特異的にシンシチン14-16やフェマトリン遺伝子17として獲得され、胎盤における細胞融合に重要な機能を果たしている。
このように哺乳類の適応放散にもレトロトランスポゾン/ウイルスが重要な役割を果たしたことが明らかになってきた。これは哺乳類のゲノム解析、ゲノム機能解析が進んだことによるものであり、近い将来、鳥類や爬虫類などのゲノム機能解析が進むに従って、“レトロトランスポゾン/ウイルスからの遺伝子獲得”は広く生物進化に関わる機構であることが見えてくると予想している。
この機構が進化の推進力の一つだとすれば、単に過去におきた出来事であるだけでなく、生物の存在とともに現在、そして未来にも続いていくと考えられるだろう。前項で引用したエボラウイルスやコアラのレトロウイルスの話(スピンオフ3参照)は、まさには現在進行形の出来事である。
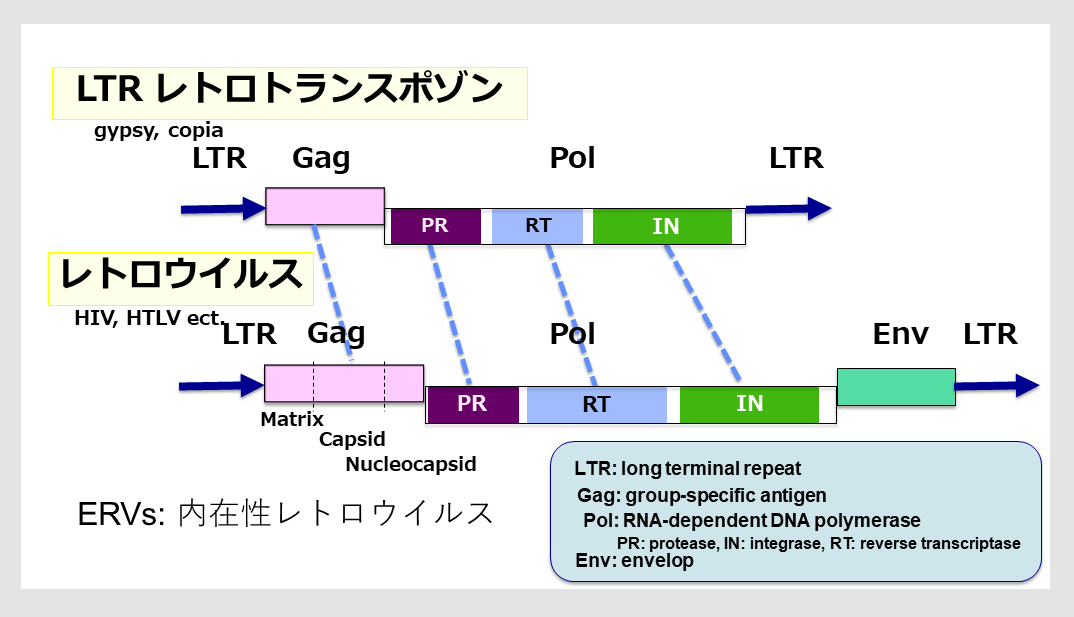
LTRレトロトランスポゾンはエイズウイルス(HIV)や成人性白血病ウイルス(HTLV)などのレトロウイルスと構造的によく似ている。
自己増殖に必要なGag、Pol遺伝子に加え、レトロウイルスは感染に必要なEnv遺伝子を持つ。
ゲノムに挿入されたレトロウイルスは内在性レトロウイルス(endogenous retrovirus, ERV)と呼ばれる。
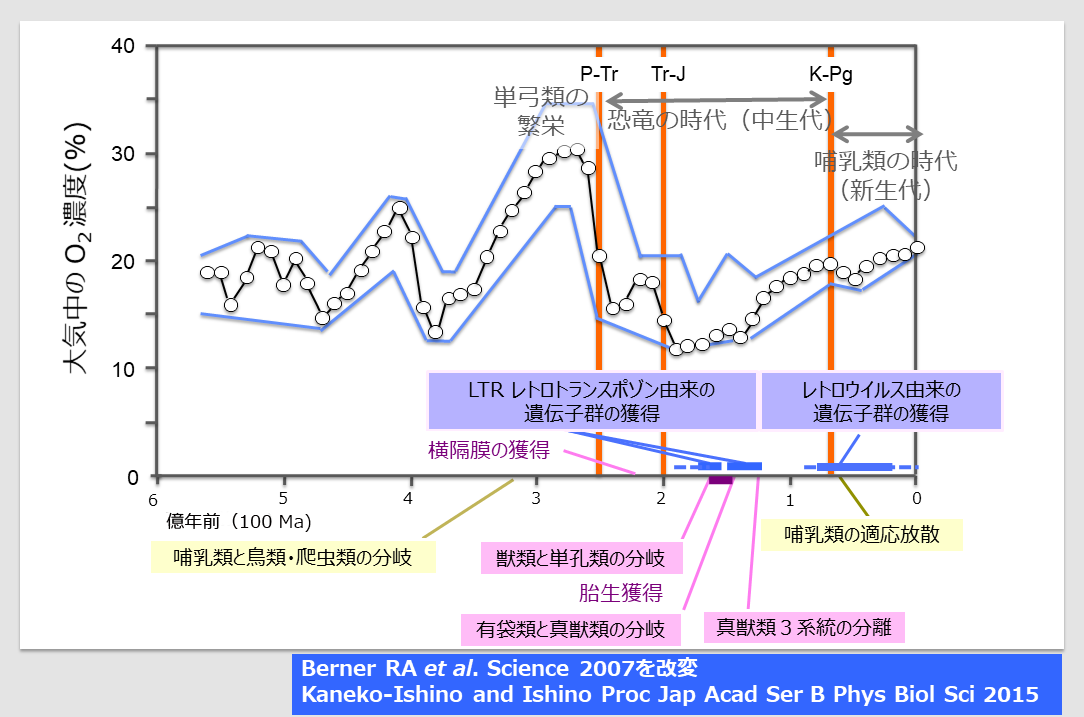
胎生の哺乳類(獣類)の誕生は、2つの生物大絶滅(P-TrとTr-J)に挟まれ地球上の生命の歴史で最も酸素濃度が低い時に起きている。K-Pgでの恐竜絶滅後に哺乳類は大放散をした。SIRH/RLT遺伝子群は前者の時期、レトロウイルス由来の遺伝子は後者の時期に獲得された。
P-Tr: ペルム紀-三畳紀境界の大絶滅
Tr-J: 三畳紀—ジュラ紀境界の大絶滅
K-Pg:白亜紀—古第三紀境界の大絶滅
参考文献
- Nakamura T M and Cech T R. Reversing time: origin of telomerase. Cell 92, 587–590 (1998).
- Agrawal A, Eastman Q M and Schatz D G. Transposition mediated by RAG1 and RAG2 and its implications for the evolution of the immune system. Nature 394,744–751 (1998).
- Hiom K, Mele M and Gellert M. DNA transposition by the RAG1 and RAG2 proteins: a possible source of oncogenic translocations. Cell 94, 463–470 (1998).
- Lisch D R, Freeling M, Langham R J and Choy M Y. Mutator transposase is widespread in the grasses. Plant Physiol 125,1293–1303 (2001).
- Hudson M E, Lisch D R and Quail P H. The FHY3 and FAR1 genes encode transposaserelated proteins involved in regulation of gene expression by the phytochrome A-signaling pathway. Plant J 34, 453–471 (2003).
- Lin R, Ding L, Casola C, Ripoll D R, Feschotte C and Wang H. Transposase-derived transcription factors regulate light signaling in Arabidopsis. Science 318, 302–1305 (2007).
- Mi S, Lee X, Li X-P, Veldman G M, Finnerty H, Racie L, LaVallie E, Tang X-Y, Edouard P, Howes S, Keith J C Jr and McCoy J M. Syncytin is a captive retroviral envelope protein involved in human placental morphogenesis. Nature 403, 785–789 (2000).
- Dupressoir A, Vernochet C, Bawa O, Harper F, Pierron G, Opolon P and Heidmann T. Syncytin-A knockout mice demonstrate the critical role in placentation of a fusogenic, endogenous retrovirusderived, envelope gene. Proc Natl Acad Sci USA 106, 12127–12132 (2009).
- Lavialle C, Cornelis G, Dupressoir A, Esnault C, Heidmann O, Vernochet C and Heidmann T. Paleovirology of ‘syncytins’, retroviral env genes exapted for a role in placentation. Philos Trans R Soc Lond B Biol Sci 368, 20120507 (2013).
- Nakaya Y, Koshi K, Nakagawa S, Hashizume K and Miyazawa T. Fematrin-1 is involved in fetomaternal cell-to-cell fusion in Bovinae placenta and has contributed to diversity of ruminant placentation. J Virol 87, 10563–10572 (2013).
5. 哺乳類の胎生獲得の選択圧はなにか?:地球上の大気酸素濃度の変遷
PEG10の獲得は、現存する哺乳類各種のゲノム解析から、単孔類と獣類が分岐した1億6千6百万年前(166 Ma)から真獣類と有袋類が分岐する1億4千8百万年前(148 Ma) までの間で、哺乳類が胎生を獲得した時期が一致する(図10)。
一方で、PEG11/RTL1やその他のSIRH/RTL, PNMA遺伝子群の獲得(スピンオフ3参照)は、その後、真獣類の共通祖先から現在の北方獣類(北半球で進化した哺乳類で真種齧獣類とローラシア獣類を含む)、アフリカ獣類、異節類(南アメリカの哺乳類)が分岐する1億2千万年前(120 Ma) までの間である。
これらの遺伝子は獲得されて以降、ヒトやマウスでは現在に至るまで保存されている。しかし、SIRH11のようにいくつかの系統では機能を失ったものもある(スピンオフ2参照)。
ダーウィンの進化論に従えば、これらの遺伝子は真獣類の生殖に有利に働いたために選択を受けて残った遺伝子であることになる(Headlines 6参照)。ダーウィンの進化論の重要な要因は、生物に起きる “突然変異” と“環境による選択” の2つである。それでは、哺乳類において胎生成立に選択圧を与えた環境要因とは一体何なのだろうか?
DNA解析と化石記録から推測された生物進化と地質学的研究の成果を合わせて過去を再現すると、図9のようになる。哺乳類は今から3億1千万年前(310 Ma)に鳥類・爬虫類と分岐した。当時、地球上の大気中酸素濃度は30 %に達しており18、地上では哺乳類の祖先である単弓類が栄えていた。
しかし、2億5千5百万年前(255 Ma)に起きたペルム紀-三畳紀(P-Tr)境界の大絶滅で、単弓類の大部分は絶滅した。この大絶滅の真の原因は不明だが、地球上の大気中酸素濃度は15 %位まで減少した18。
その後、大気中酸素濃度は一時期わずかに回復したが、2億年前(200 Ma)に起きた三畳紀—ジュラ紀(Tr-J)境界の大絶滅のときに、酸素濃度はさらに12 %位まで減少した18。
この低酸素状況にもっとも適応したのは恐竜で、効率よく肺に酸素を取り込める気嚢という呼吸システムを獲得したことにより、その後、繁栄を極めた。この気嚢を使った呼吸システムは恐竜の子孫である鳥類に今でも受け継がれている。
哺乳類の祖先もこの時期に横隔膜を獲得し、肺における酸素取り込み効率は上昇したと考えられている。地球上における生命の歴史を記す顕生代(5億5千万年前から現在に至る)において、最も酸素濃度の低下した状況は、ここから1億3千年前(130 Ma)位まで続く。
このストーリーに当てはめると、胎生を獲得し、真獣類と有袋類が分岐した時期(166-148 Ma)は、地球上で最も酸素濃度が低かった時代にあたる。この頃の哺乳類の祖先は、恐竜の目を逃れて生活する夜行性の小さな動物であったと予想されている。子供を母親の胎内で育てる胎生という生殖機構は、胎盤を通じて母親から胎児に酸素を供給できるシステムであり、低酸素環境下では有利な条件として選択された可能性が高いと考えられる。この時に機能を得たのが哺乳類特異的獲得遺伝子SIRH/RTL遺伝子群だったのだろう。
その後、大気中酸素濃度は上昇し、白亜紀—古第三紀(K-Pg)境界の大絶滅でわずかに減少したものの、哺乳類の適応放散が起きる時期には現在の20 %に近い値となっている。
レトロウイルスEnvからのシンシチン遺伝子の獲得は、霊長類、齧歯類、食肉類、反芻類などの各系統で、独立に異なるレトロウイルスから起きている。これは高濃度の大気中酸素濃度下での適応放散という新しい局面で、それぞれの系統が環境に適応する際の進化に使われたのだろう。
このような獲得遺伝子はシンシチン遺伝子以外にも、まだ未同定の状態でヒトゲノム内に存在している可能性がある。その中には、霊長類、大型類人猿、ヒト科を経てヒトへの進化の各段階に関わった獲得遺伝子もあると予想され、今後のこの分野の研究展開が楽しみである。
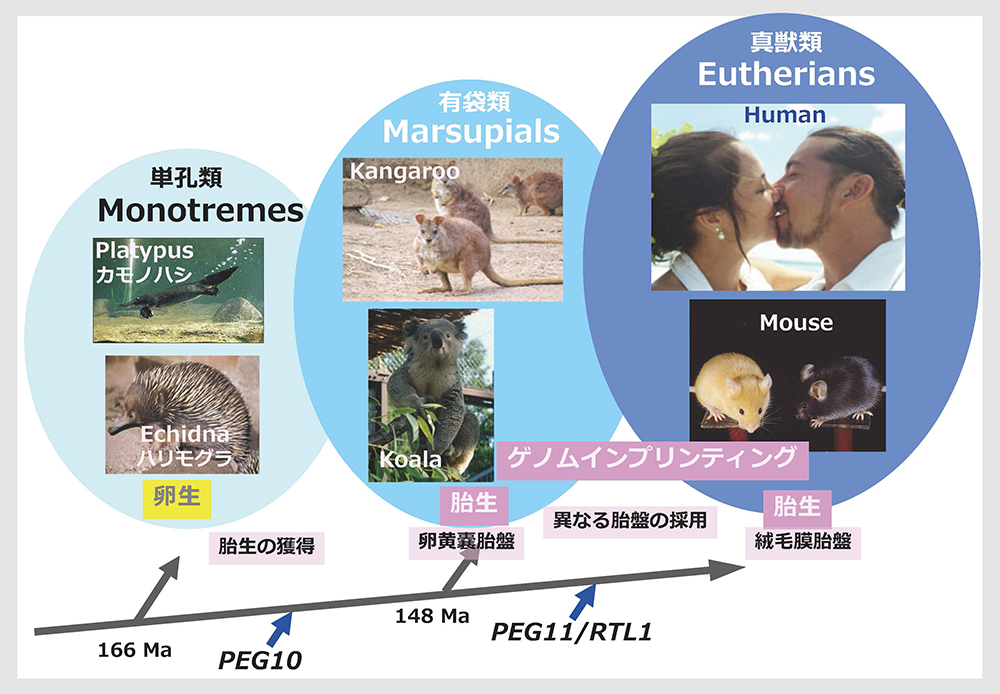
哺乳類は胎生を獲得した時期にPEG10を、有袋類と分岐した真獣類が絨毛膜胎盤を獲得した時期にPEG11/RTLを獲得している。
出典(研究紹介 文献27)
- Kaneko-Ishino T and Ishino F. Mammalian-specific genomic functions: Newly acquired traits generated by genomic imprinting and LTR retrotransposon- derived genes in mammals. Proc Jpn Acad Ser B Phys Biol Sci 91, 511-538 (2015).
参考文献
- Berner, R.A., Vandenbrooks, J.M. and Ward, P.D. Evolution. Oxygen and evolution. Science 316, 557–558 (2007).

