-
研究のはじまり
ゲノムインプリンティングは動物では哺乳類だけがもっている遺伝子発現のしくみである。1984年に、片親由来のゲノムのみでは正常に発生しないことから、父親・母親由来のゲノムに差異があることが・・・
-
インプリント遺伝子PegとMeg
雌性単為発生胚と正常受精胚で発現に差のある遺伝子を引き算で濃縮する方法を開発し、父性発現遺伝子群(PEGと命名)の同定を進めた。この方法を主として12個のPEGを単離し・・・
-
DMRの起源
インプリント遺伝子の発見に伴って、ゲノムインプリンティングは領域制御の片親性遺伝子発現機構であり、その制御の中心的な役割を果たすのは、雌雄のゲノムでDNAメチル化の差異を示す領域・・・
-
哺乳類特異的獲得遺伝子PEG10と胎盤形成
胎盤形成に必須なインプリント遺伝子は、母親性2倍体が初期胚致死を起こすマウス6番染色体近位部のインプリント領域にあると考え、ヒト相同領域の探索からPEG10遺伝子を発見した。
-
真獣類特異的獲得遺伝子PEG11・SIRH遺伝子群と哺乳類らしさ
マウス染色体12番遠位部のインプリント領域では母親性2倍体マウスが胎児期後期からの成長遅滞や胎児期後期・新生児致死という表現型が見られる。我々はこれが胎盤の機能異常によるもの・・・
-
ゲノムインプリンティングと獲得遺伝子から見る生物進化
なぜ、哺乳類では発生に重要な遺伝子が片親性発現という生存に不利な機構が維持されているのか? 両親由来の2本のゲノムから遺伝子発現をすることは、劣性遺伝病の発症を防ぐ機構として・・・
-
7. PEG11/RTL1は真獣類の胎生機構への対応や脳機能の発達にも関係した
哺乳類らしさの構築にPEG11/RTL1が重要な貢献した2つの新しい証拠が加わった。胎児期及び新生児期特異的に筋肉発生に関わること、脳神経系の発達にも重要な機能を持つこと・・・
-
8. 神経細胞(ニューロン)で発現し脳を操るSirh4, 5, 6/Rtl8c, a, b
ニューロンで機能する遺伝子としてヘッドライン7で紹介したKagami-Ogata症候群、Temple症候群の原因遺伝子になっているPEG11がある。最近、PEG10もニューロンで発現し、・・・
-
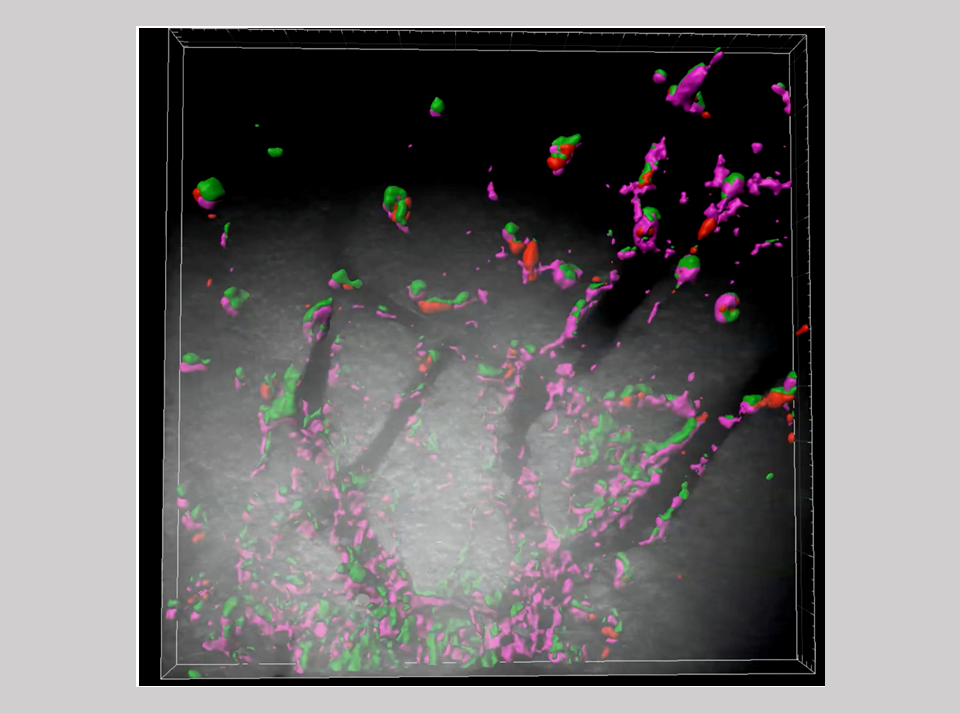
9. 脳の免疫細胞(ミクログリア)で発現し脳を護るSirh3, 8, 10, 11
自然免疫は、動物界に広く保存される基本的な生体防御システムで、病原体など体に異物が侵入した時、マクロファージや好中球など貪食作用を持つ細胞がいち早く反応し排除する働きをしている。・・・
-
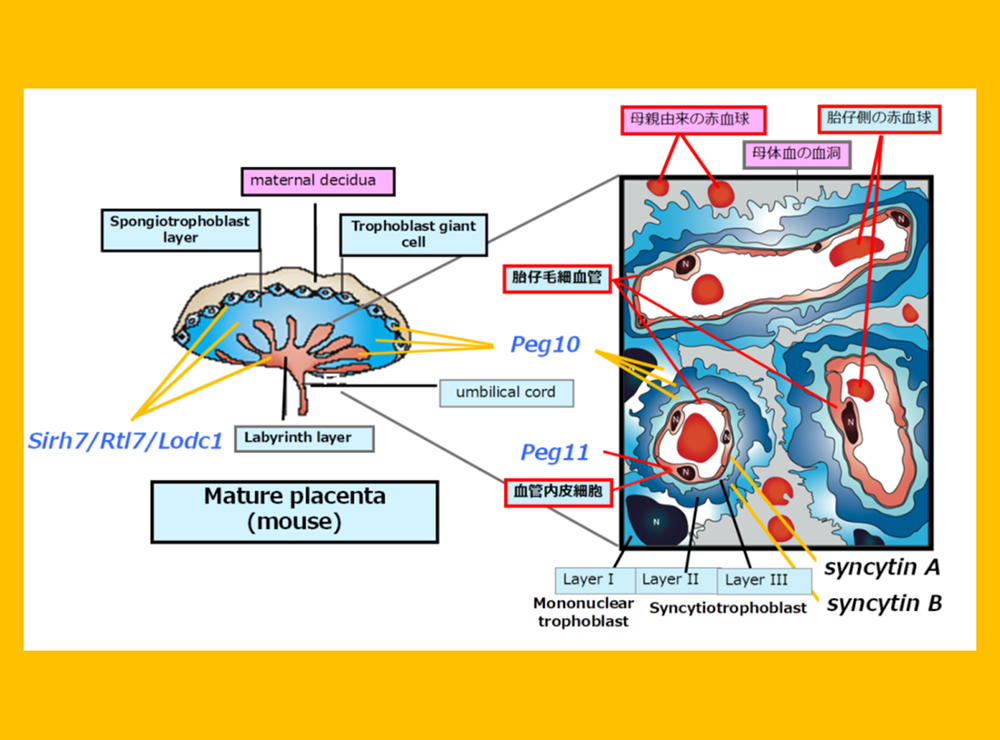
10. 胎盤は進化の実験場 ―胎盤形成におけるウイルスからの遺伝子獲得の重要性―
ここまで、PEG10が胎盤の初期形成に(ヘッドライン4)、PEG11/RTL1が胎盤内の胎児毛細血管の維持に(ヘッドライン5)、そしてSirh7/Ldoc1が胎盤の内分泌制御に機能(ヘッドライン5)・・・
1. 研究のはじまり
~インプリント遺伝子の網羅的探索からゲノムインプリンティングの生物学的意義の解明を目指す~
ゲノムインプリンティングは動物では哺乳類だけがもっている遺伝子発現のしくみである。1984年に、片親由来のゲノムのみでは正常に発生しないことから、父親・母親由来のゲノムに差異があることが見つかり 名付けられた現象である1-3(図1)。1985年には、X線照射で染色体転座を起こした部分的片親性2倍体マウスを用いて、常染色体上で父親・母親由来のゲノムの機能的差異がある場所がマップされ、その後もインプリント領域は増えていった4,5(図2)。
我々はインプリント領域には片方のゲノムからしか発現しない “インプリント遺伝子” が存在すると仮定し、1989年より、ゲノムインプリンティングの発見者の一人である英国ケンブリッジのスラーニー博士の研究室に留学し、インプリント遺伝子の体系的な探索を始めた。少なくともインプリント領域に対応する遺伝子数を見込み、網羅的な探索に意味があると考えた。インプリント遺伝子は次のようカテゴリーの遺伝子が含まれることを予想していた。
- ① 外来DNA由来の遺伝子(ゲノムインプリンティングはウイルスなどの外来のゲノムが飛び込んだ事に対する防御機構として成立したと考えていたため)
- ② 哺乳類特異的な遺伝子(ゲノムインプリンティングは哺乳類特異的な機構であり、哺乳類にしかない遺伝子が含まれる可能性も考えたため)
- ③ 哺乳類の特徴である胎生を支える胎盤の構造・機能に関係する遺伝子群(片親由来のゲノムのみを持つ単為発生胚が胎盤の異常を示すため)
- ④ 着床時の初期母子免疫寛容に関わる遺伝子(胎盤は母親にとって異物であるため)
特に①の遺伝子が多数見つかることを期待していた。
研究のコンセプトをまとめると下図のようになる。
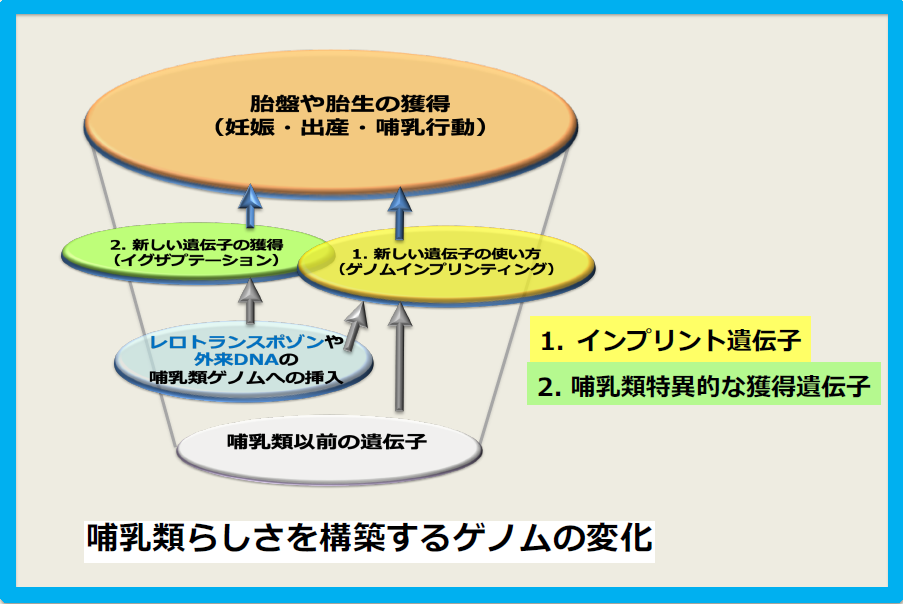
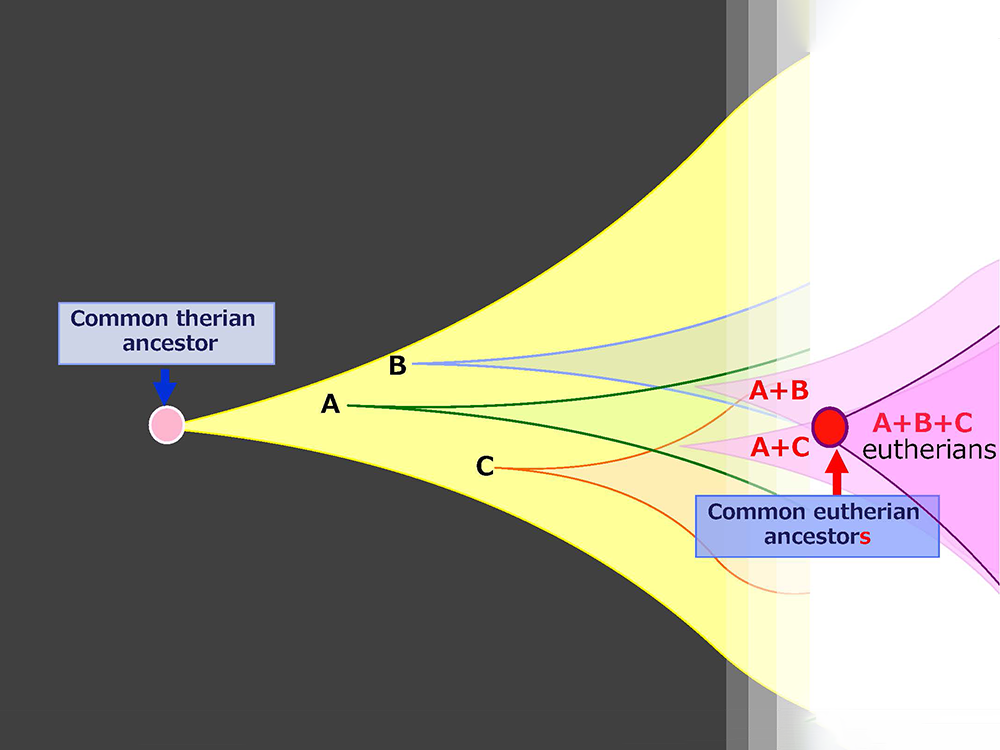
コンセプト図の黄緑と黄色のだ円が重なった部分の遺伝子の発見を研究の一番の目的とした。なぜなら、哺乳類だけの遺伝子発現のしくみを持つインプリント遺伝子群の中の獲得遺伝子は、哺乳類になって初めて手に入れた遺伝子であり、その機能は哺乳類らしさ ~胎盤や胎生などの哺乳類の特徴~ に関わっているだろうと考えたからである。
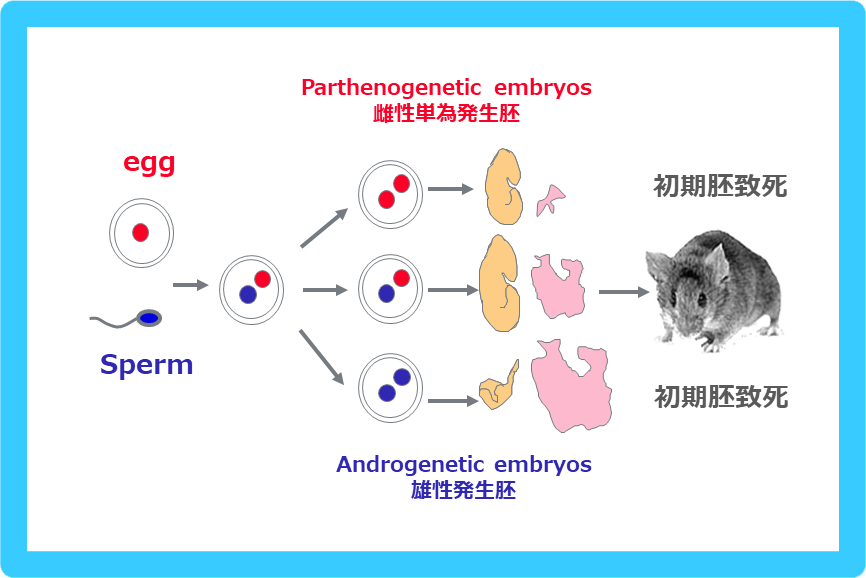
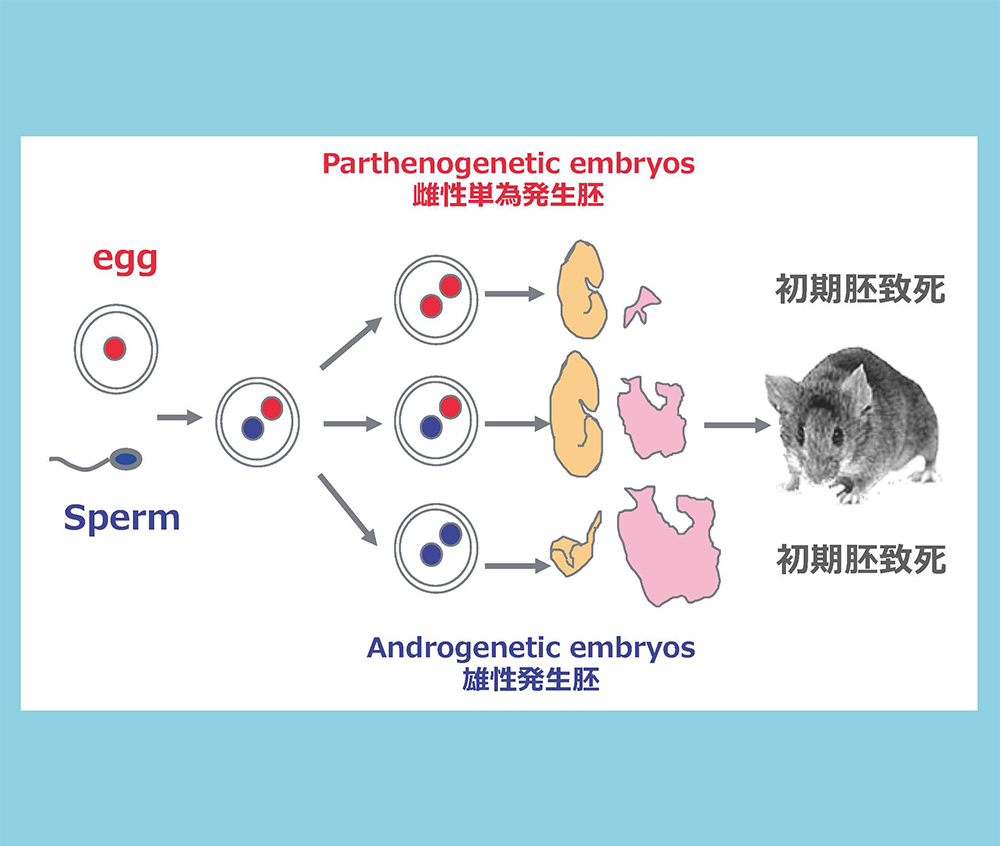
受精後、精子と卵子由来の前核(青丸と赤丸)が融合する前に、入替え手術を行い作製した赤丸2つ、青丸2つからなる雌性単為発生胚、雄性(雄核)発生胚はどちらも初期胚致死性を示す。前者は胎児はやや小さいが正常に発生しているが、著しい胎盤の形成不全を示す。後者は胎児の発生が遅れ、胎盤(一部の重要な組織を欠く)の過剰形成が起きている。この実験により、哺乳類の正常な個体発生には、父親・母親由来の両方のゲノムが必要であること、父親・母親由来のゲノムは、それぞれ異なる役割をしていることが明らかになった。
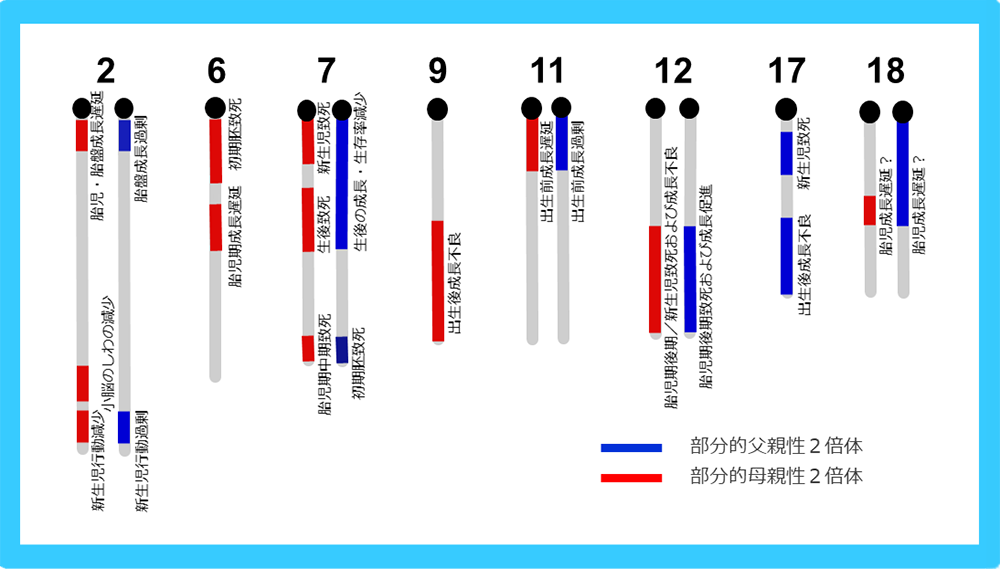
X線を当てて染色体転座(ロバートソニアン転座)を起こしたマウスを掛け合わせることで、染色体の一部を片親性2倍体で持つマウスを作製することができる。発生、生育、行動にさまざまな異常表現型が見られた領域は、父親・母親由来のゲノムに機能的差異があると考えられインプリント領域と呼ばれる。我々は、胎児期に致死性を示すインプリント領域には胎盤に関係する重要なインプリント遺伝子があると考えた。例えば、染色体6番近位部の母親性2倍体が示す初期胚致死は、図1の雌性単為発生胚の初期胚致死性の原因インプリント遺伝子の存在を、また染色体12番遠位部の母親性2倍体が示す胎児期後期・新生児の死および成長不良は、ここに胎盤の機能に重要なインプリント遺伝子の存在を示唆すと考えた。
参考文献
- Surani M A, Barton S C and Norris M L. (1984) Development of reconstituted mouse eggs suggests imprinting of the genome during gametogenesis. Nature 308, 548-550.
- McGrath J and Soter D. (1984) Completion of mouse embryogenesis requires both the maternal and paternal genomes. Cell 37, 179-183.
- Mann J R and Lovell-Badge R H. (1984) Inviability of parthenogenones is determined by pronuclei, not egg cytoplasm. Nature 310, 66-67.
- Cattanach B M and Kirk M. (1985) Differential activity of maternally and paternally derived chromosome regions in mice. Nature 315, 496–498.
- Cattanach B M and Beechey C V. (1990) Autosomal and X-chromosome imprinting. Development Suppl, 63-72.
2. インプリント遺伝子PEGとMEG
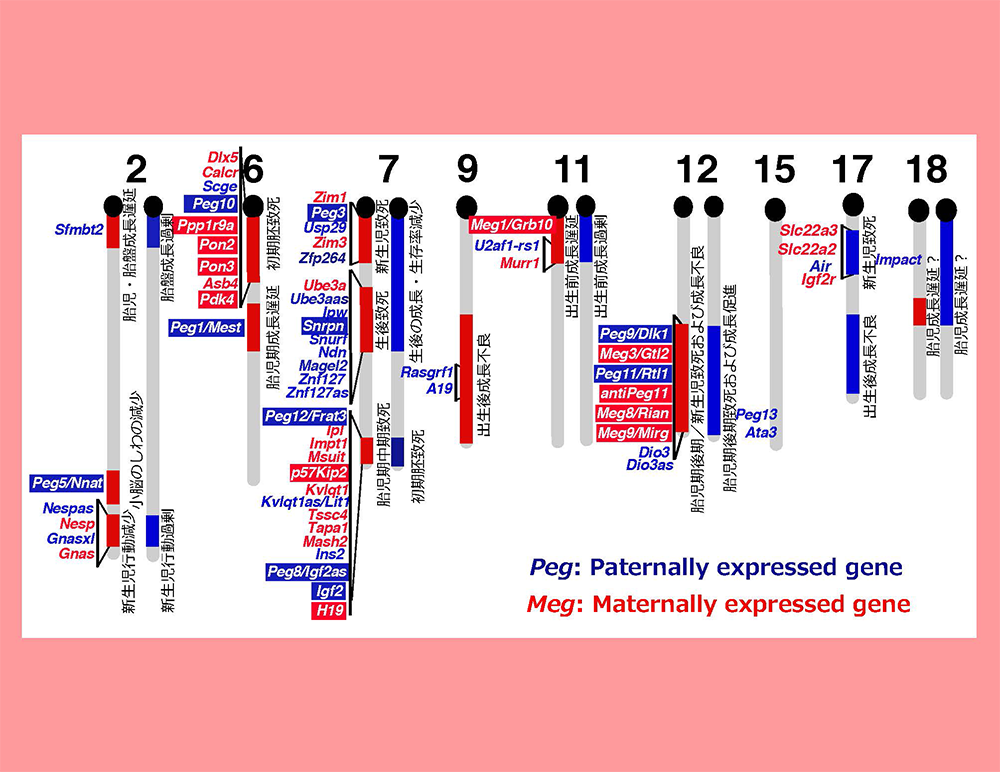
図1の雌性単為発生胚と正常受精胚で発現に差のある遺伝子を引き算で濃縮する方法を開発し6、父性発現遺伝子群(Paternally expressed gene, PEGと命名)の同定を進めた。この方法を主として12個のPEGを単離し、8ヵ所のインプリンティング領域に同定した6-13。また、雄性発生胚と正常受精胚で発現差のある母性発現遺伝子群(Maternally expressed gene, MEGと命名)を11個、5カ所のインプリンティング領域に同定した13-15。これは1研究グループにおいて最多の同定数である。この研究成果から図1と図2が繋がり、PEGとMEGの存在がゲノムインプリンティング現象の実体であることが明らかになった。インプリント領域は複数のPEGとMEGが混在したクラスターであることがわかり、1つのインプリント遺伝子の周辺に多数のインプリント遺伝子が見つかった(図3)。
当初は、母親のリソースを巡る父親・母親由来のゲノム間のコンフリクト(対立)から、PEGは胎児・胎盤の成長促進、MEGは逆に成長抑制に機能するというコンフリクト仮説が提唱されていた16。しかし、生化学的機能が多様(または不明)なインプリント遺伝子が増えると、コンフリクト仮説の例外が増え、遺伝子の共通機能からゲノムインプリンティングの生物学的意義を考えることは逆に難しくなった17。発見されたインプリント遺伝子はすべてが胎盤で発現する遺伝子であったため、これを新胎盤仮説として提唱した17。胎盤での機能が不明なものも多く、ただ機構的に胎盤で発現しているだけという可能性もある。
我々が初期に同定したインプリント遺伝子の中にはPeg1/Mest18, Peg319のように、父親からこの遺伝子の欠失を受け継いだメスが、子育て放棄をするという面白い異常が観察されている。しかし、遺伝子カテゴリー①で予想した「外来DNA由来の遺伝子」はPEG10とPEG11のみで、期待していたより数は少なかった。
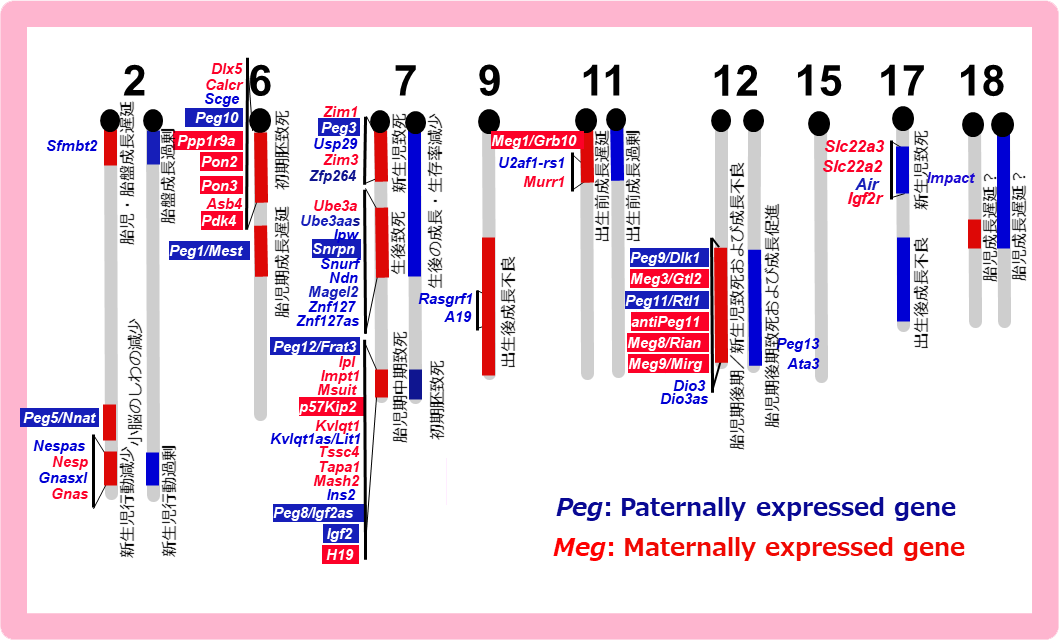
マウスで同定された主要なインプリント遺伝子(PEG(青)とMEG(赤))の位置を示す。白抜きにした遺伝子は我々の研究室で分離したインプリント遺伝子(既知のものも含む)を表している。予想通り、ほとんどのPEGとMEGは図2のインプリント領域にマップされた。また一つのインプリント領域は複数のPEGとMEGから構成されることから、ゲノムインプリンティングは領域制御機構であることがわかる(図4参照)。一方で、各インプリント領域の示す表現型異常の原因遺伝子はこの中の1つか2つであり、多くの機能不明なインプリント遺伝子が存在することも明らかとなった。
参考文献
- Kaneko-Ishino T, Kuroiwa Y, Miyoshi N, Kohda T, Suzuki R, Yokoyama M, Viville S, Barton S C, Ishino F* and Surani A*. Peg1/Mest imprinted gene on Chromosome 6 identified by cDNA subtraction hybridization. Nat Genet 11, 52-59 (1995).
- Kuroiwa Y, Kaneko-Ishino T, Kagitani F, Kohda T, Li L-L, Tada M, Suzuki R, Yokoyama M, Shiroishi T, Wakana S, Barton S C, Ishino F* and Surani A*. Peg3 imprinted gene on proximal chromosome 7, encodes for a zinc finger protein. Nat Genet 12, 186-190 (1996).
- Kagitani F, Kuroiwa Y, Wakana S, Shiroishi T, Kobayashi S, Kohda T, Kaneko-Ishino T and Ishino F. Peg5/Neuronatin is an imprinted gene located on sub-distal chromosome 2 in the mouse. Nucl Acids Res 25, 3428-3432 (1997).
- Okutsu T, Kuroiwa Y, Kagitani F, Kai M, Aisaka K, Tsutsumi O, Kaneko Y, Yokomori K, Surani M A, Kohda T, Kaneko-Ishino T and Ishino F. Expression and imprinting status of human PEG8/IGF2AS, a paternally expressed antisense transcript from the IGF2 locus, in Wilms' tumors. J Biochemistry 127, 475-483 (2000).
- Kobayashi S, Wagatsuma H, Ono R, Ichikawa H, Yamazaki M, Tashiro H, Aisaka K, Miyoshi N, Kohda T, Ogura A, Ohki M, Kaneko-Ishino T and Ishino F. Mouse Peg9/Dlk1 and human PEG9/DLK1 are paternally expressed imprinted genes closely located to the maternally expressed imprinted genes: mouse Meg3/Gtl2 and human MEG3. Genes to Cells 5, 1029-1037 (2000).
- Ono R, Kobayashi S, Wagatsuma H, Aisaka K, Kohda T, Kaneko-Ishino T and Ishino F. A retrotransposon-derived gene, PEG10, is a novel imprinted gene located on human chromosome 7q21. Genomics 73, 232-237 (2001).
- Kobayashi S, Kohda T, Ichikawa H, Ogura A, Ohki M, Kaneko-Ishino T and Ishino F. Paternal expression of a novel imprinted gene, Peg12/Frat3, in the mouse 7C region homologous to the Prader-Willi syndrome region. Biochem Biophys Res Commun 290, 403-408 (2002).
- Ono R, Shiura H, Abratani Y, Kohda T, Kaneko-Ishino T and Ishino F. Identification of a large novel imprinted gene cluster on mouse proximal chromosome 6. Genome Res 13, 1696-1705 (2003).
- Miyoshi N, Kuroiwa Y, Kohda T, Shitara H, Yonekawa H, Kawabe T, Hasegawa H, Barton S C, Surani M A, Kaneko-Ishino T and Ishino F. Identification of the Meg1/Grb10 imprinted gene on mouse proximal chromosome 11, a candidate for the Silver-Russell syndrome gene. Proc Natl Acad Sci USA 95, 1102-1107 (1998).
- Miyoshi N, Wagatsuma H, Wakana S, Shiroishi T, Nomura M, Aisaka K, Kohda T, Surani M A, Kaneko-Ishino T and Ishino F. Identification of an imprinted gene, Meg3/Gtl2 and its human homologue MEG3, first mapped on mouse distal chromosome 12 and human chromosome 14q. Genes to Cells 5, 211-220 (2000).
- Moore T and Haig D. Genomic imprinting in mammalian development: a parental tug-of-war. Trends Genet 7, 45-49 (1991).
- Kaneko-Ishino T, Kohda T and Ishino F. The regulation and biological significance of genomic imprinting in mammals. J Biochem 133, 699-711 (2003).
- Lefebvre L, Viville S, Barton S C, Ishino F, Keverne E B and Surani M A. Abnormal maternal behaviour and growth retardation associated with loss of the imprinted gene Mest. Nat Genet 20, 163-169 (1998).
- Li L-L, Keverne E B, Apricio S A, Ishino F, Barton S C and Surani M A. Regulation of maternal behavior and offspring growth by paternally expressed Peg3. Science 284, 330-333 (1999).
3. DMRの起源
〜片親性発現の分子機構から生物学的意義を考える〜
インプリント遺伝子の発見に伴って、ゲノムインプリンティングは領域制御の片親性遺伝子発現機構であり、その制御の中心的な役割を果たすのは、雌雄のゲノムでDNAメチル化の差異を示す領域(Differentially methylated region: DMR)であることがわかった17,20-21。DMRのメチル化の有無によって父親由来のゲノムからはPEG、母親由来のゲノムからはMEGだけが発現する(図4, インスレータモデル22,23)。言い換えると、DNAメチル化状態の異なる2つのゲノムによってPEGとMEGの両方の発現が保証され、正常な発生が進む仕組みである17。
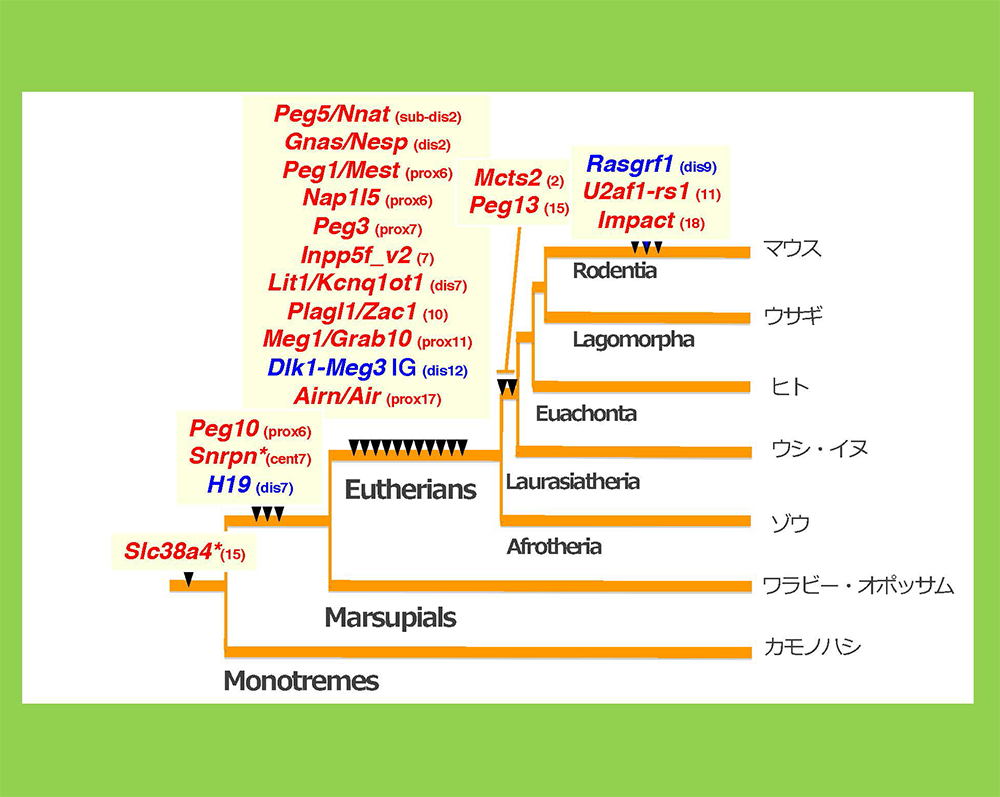
なぜ、このような特殊な状況が生じたのだろうか?プロモータ、エンハンサ、インスレータ、インスレータ結合タンパク質は真核細胞に共通して存在し、この仕組みの中で哺乳類特異的な要素はDMRだけである。各DMR間にDNA配列の相同性は全く無く、この疑問は長らく未解決であった。しかし、PEG10という外来のDNA由来の遺伝子の発見11とPEG10プロモータがDMRになっているという発見(図5)24をきっかけとして、DMR配列こそが外来のDNA配列の挿入から成っており、DMRにあたる配列の挿入とゲノムインプリンティング制御が始まった時期が一致するという事実を突き止めた(図6)25-28。
PEG10遺伝子の挿入に伴い、鳥類や単孔類のゲノムには無かったCpG含量の高い新しいピーク(メチル化のターゲットになりやすい)が出現したが、そこがPEG10のプロモータ部位であり、PEG10-DMRでもある部位と一致したのがわかる(図5)。図6にはPEG10を含めて哺乳類の進化上、各領域のDMRがゲノムに新しく出現した時期を示している。*で示した2つの例外を除き、全てがインプリンティング制御の獲得時期と一致している。例外となるSlc38a4, Snrpn領域はどちらも真獣類でインプリント制御が見られるが、DMRとなるDNA配列自体の出現時期はそれより早い。これらの場合、DMRのすぐ隣で染色体組み換えという大規模なゲノム変化が真獣類で起きていた25.29。すなわち新しいインプリント領域の出現は、その領域へのDMR配列の挿入や染色体組換えなどの大規模なゲノム配列変化が生じた時期と一致することがわかる。
DMRには遺伝子/アンチセンスmRNAのプロモータやインスレータ、サイレンサなど、cisで機能し周辺の遺伝子発現に影響を与える活性があることが知られている。この活性をDNAメチル化で制御しているのがゲノムインプリンティングである。これは①で予想した「外来DNA由来の遺伝子」ではなく、「外来DMR」の挿入に対する防御機構としてゲノムインプリンティングが成立したことを示唆している。ゲノムの防御機構というアイデアは形を変えて復活したことになる。
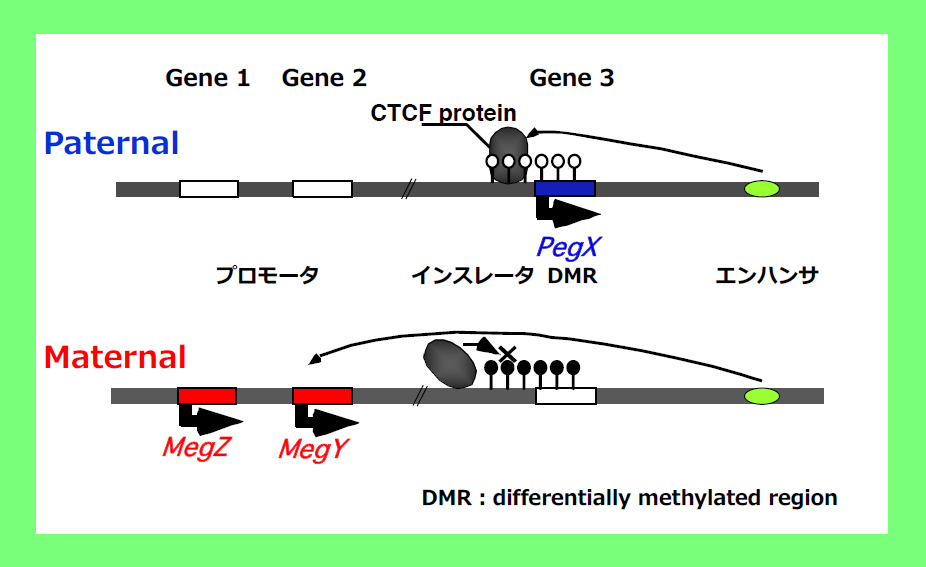
インスレータモデルはDMR配列のメチル化の有無でPEGとMEGを制御するゲノムインプリンティングの代表的機構である。
上段:Paternal chromosomeでは、Gene 3のプロモータ上流にあるインスレータ配列にCTCFタンパク質(インスレータ結合タンパク質)が結合することで、下流のエンハンサ(プロモータ活性を上げる機能を持つ)の作用が止められるため、上流のGene 1、Gene 2は発現できない状態にある。
下段:Maternal chromosomeでは、Gene 3のプロモータ領域とインスレータ配列がDNAメチル化を受けることで、Gene 3は発現抑制される。一方、CTCFタンパク質がインスレータに結合できなくなるためGene 1、Gene 2がエンハンサの作用を受け発現が誘導される。
Gene 3のプロモータとインスレータ領域は、父親・母親由来のゲノムでDNAメチル化の差異のある領域(Differentially methylated region:DMR)であり、インプリント制御に中心的な役割を果たす。インスレータの存在によりPEGとMEGが同一の染色体から同時に発現できない状態にある。
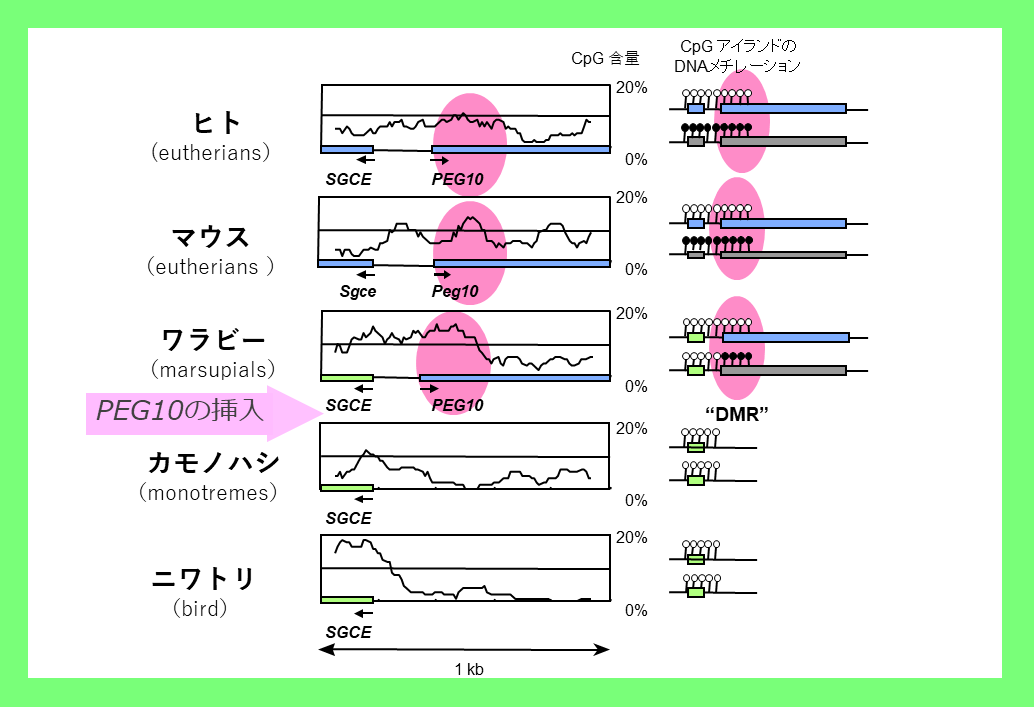
PEG10領域を胎生のヒト・マウス(真獣類)およびワラビー(有袋類)、卵生のカモノハシ(単孔類)、ニワトリ(鳥類)と比較すると、PEG10プロモータ領域の挿入によりCpG含量が高いピークが胎生の動物に生じており(左のピンク色の領域)、その位置はDMRに相当している(右のピンク色の領域)。
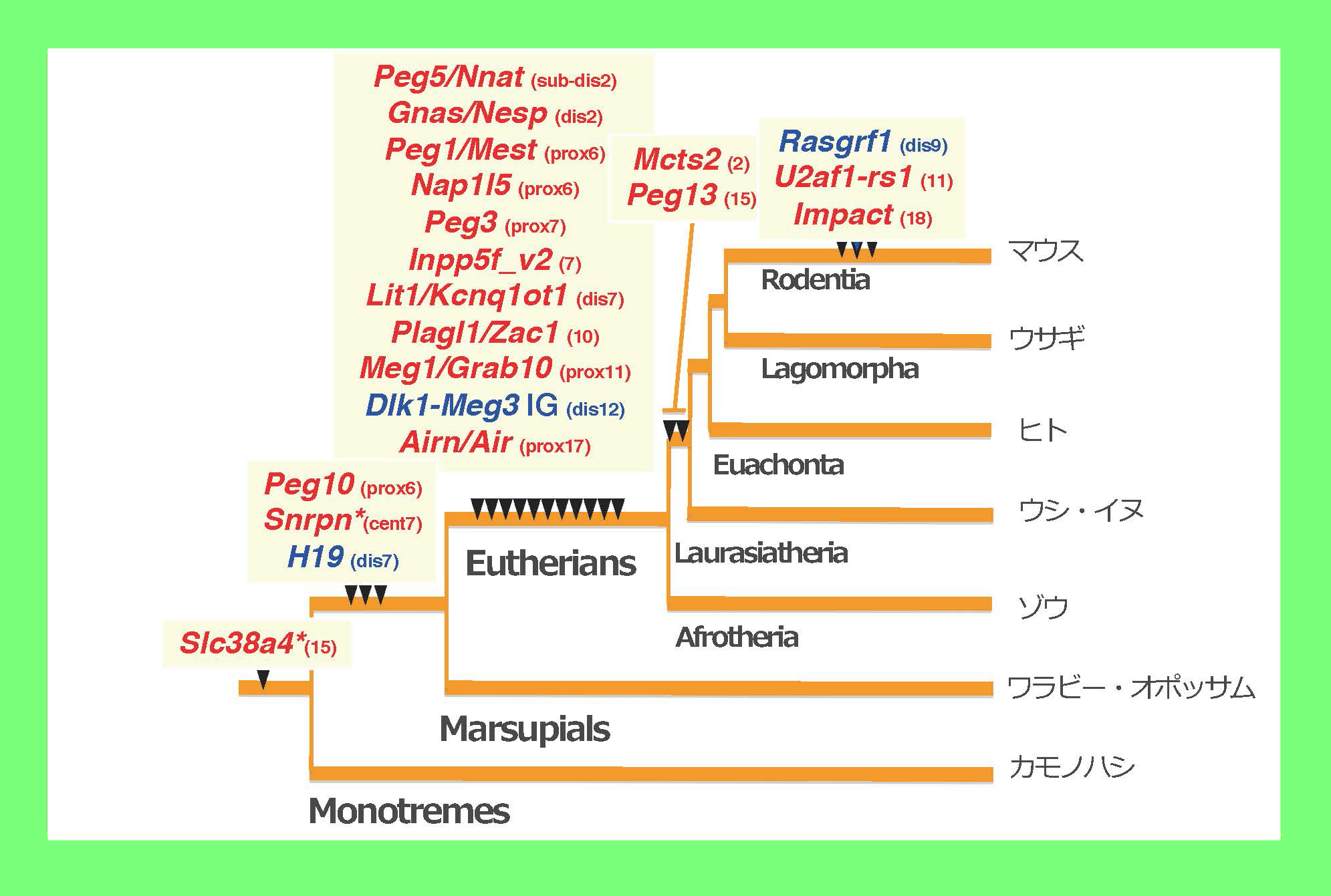
各インプリント領域のDMRに相当するDNA配列がゲノム上に出現した(挿入された)時期を表す。これらはインプリント領域の出現と一致している(2つの例外は*で示す)。PEG10-DMRとH19-DMRは有袋類と真獣類の分岐前にゲノムに挿入され、大部分のDMRは真獣類の共通祖先ゲノムに挿入された。その後、系統特異的にインプリント領域がDMRの挿入とともに出現していることがわかる。*で示したSlc38a4とSnrpn 領域は真獣類特異的なインプリント領域であるが、DMRに相当するDNA配列の挿入時期はそれより早い。どちらの領域も真獣類の共通祖先においてDMRの極近傍で染色体組み換えが起き、全く新しい染色体領域となっている。すなわちゲノム配列の挿入や大規模な変化とインプリント領域の出現は一致しており、DMRとしてメチル化の差異が生じることがわかる。()内はマウス染色体番号と部位を示す(prox:近位部、cent:中央部、dis:遠位部)。
参考文献
- Reik W and Walter J. Genomic imprinting: parental influence on the genome. Nat Rev Genet 2, 21–32 (2001).
- Barlow D P and Bartolomei M S. Genomic imprinting in Mammals. Cold Spring Harb Symp Quant Biol 69, 357-375 (2004).
- Bell A C and Felsenfeld G. Methylation of a CTCF-dependent boundary controls imprinted expression of the Igf2 gene. Nature 405, 482-485 (2000).
- Hark A T, Schoenherr C J, Katz D J, Ingram R S, Levorse J M, Tilghman S M. CTCF mediates methylation-sensitive enhancer-blocking activity at the H19/Igf2 locus. Nature 405, 486-489 (2000).
- Suzuki S, Ono R, Narita T, Pask A J, Shaw G, Wang C, Kohda T, Alsop A E, Graves M J A, Kohara Y, Ishino F*, Renfree M B* and Kaneko-Ishino T*. Retrotransposon silencing by DNA methylation can drive mammalian genomic imprinting. PLoS Genet 3, e55 (2007).
- Suzuki S, Shaw G, Kaneko-Ishino T, Ishino F and Renfree M B. (2011) The evolution of mammalian genomic imprinting was accompanied by the acquisition of novel CpG islands. Genome Biol Evol 3, 1276-1283.
- Renfree M B, Suzuki S and Kaneko-Ishino T. The origin and evolution of genomic imprinting and viviparity in mammals. Philos Trans R Soc Lond Biol Sci 368, 20120151 (2013).
- Kaneko-Ishino T and Ishino F. Mammalian-specific genomic functions: Newly acquired traits generated by genomic imprinting and LTR retrotransposon-derived genes in mammals. Proc Jpn Acad Ser B Phys Biol Sci 91, 511-538 (2015).
- Kaneko-Ishino T and Ishino F. Evolution of viviparaity in mammals: what genomic imprinting tells us about mammalian placental evolution. Reprod Fertil Dev (2019). doi: 10.1071/RD18127.
- Hore T A, Rapkins R W and Graves J A M. Construction and evolution of imprinted loci in mammals. Trends Genet 23, 440-448 (2007).
4. 哺乳類特異的獲得遺伝子PEG10と胎盤形成
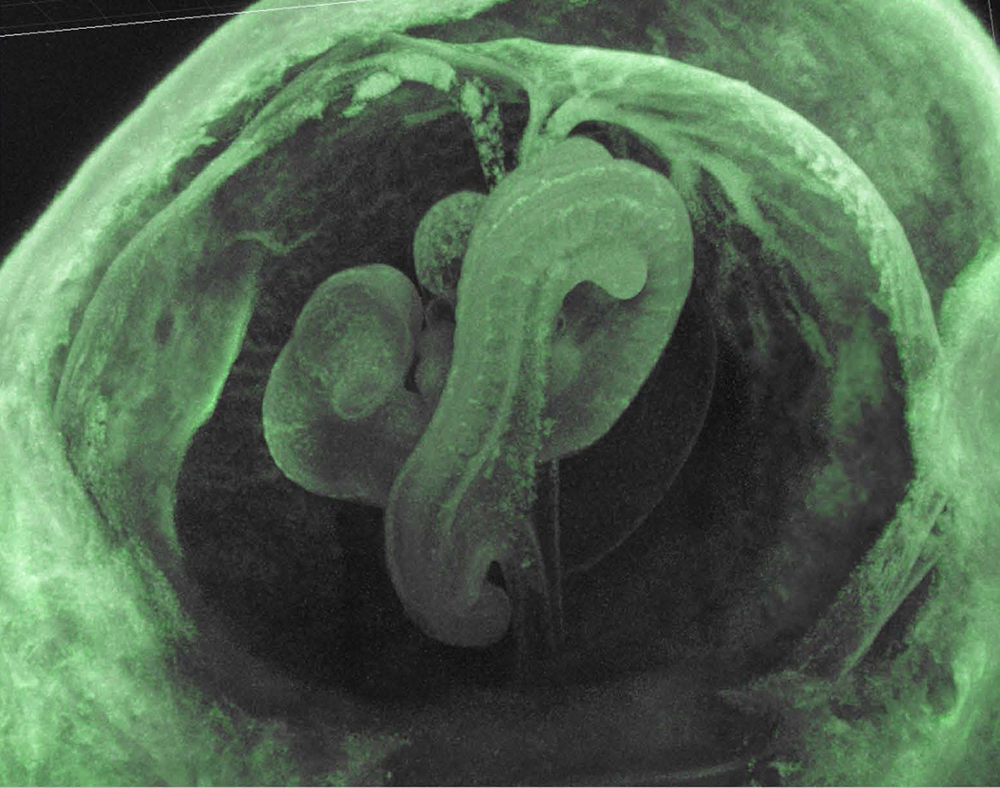
胎盤形成に必須なインプリント遺伝子は、母親性2倍体が初期胚致死を起こすマウス6番染色体近位部のインプリント領域(図2)にあると考え、ヒト相同領域の探索からPEG10遺伝子を発見した。面白いことに、これはLTRレトロトランスポゾンというレトロウイルスに類似した構造を持つ外来のDNAが哺乳類ゲノムに挿入され、それが遺伝子に変化したものだった11。鳥類や魚類には存在せず、哺乳類特異的に存在する遺伝子であった11。このような外来の遺伝子が本当に胎盤形成に必須な機能を持つのかどうか、遺伝子をノックアウトして機能を調べたところ、Peg10 KOマウスは胎盤形成不全で初期胚致死になった30(図7)。PEG10が当初に想定したカテゴリー①の外来遺伝子かつ②の哺乳類特異的遺伝子に合致するだけでなく、カテゴリー③の胎盤形成に必須なインプリント遺伝子であることも明らかになったのである。
オーストラリアの研究者とともに行った卵生の単孔類、胎生の有袋類と真獣類における比較ゲノム解析から、PEG10が有袋類と真獣類に共通する遺伝子であること、インプリント制御も有袋類と真獣類で共通にもつこと、そして新しく挿入されたPEG10プロモータ部分がDMRになっていることを明らかにした(3の図5参照)24。これから哺乳類における胎生の成立とPEG10の獲得時期が一致することが確認できた24(図8)。こうして胎生という哺乳類の特徴に関係する哺乳類特異的な獲得遺伝子という新しい概念を支える具体例を示すことができた26-29。
胎盤は母子間の栄養・酸素交換に働く機能を持つ臓器・組織の名称であり、羊膜類(爬虫類、鳥類、哺乳類からなるグループ)が共通してもつ胚体外組織(発生過程の胎児以外の部分)に由来する。有袋類は短い妊娠期間を持ち、真獣類と比べて未成熟な仔を出産するが、胎盤には卵黄嚢と漿膜が接した簡易的なものが使われている。一方、真獣類は長い妊娠期間を持ち、成熟した仔を出産するが、胎盤は尿膜と漿膜が結合して複雑な浸潤組織を持つ高機能性のものになっている(図9)。我々は既存の胚体外組織を胎盤へと変化させるきっかけの鍵となったのが、外から飛び込んできて遺伝子となったPEG10であると考えている。
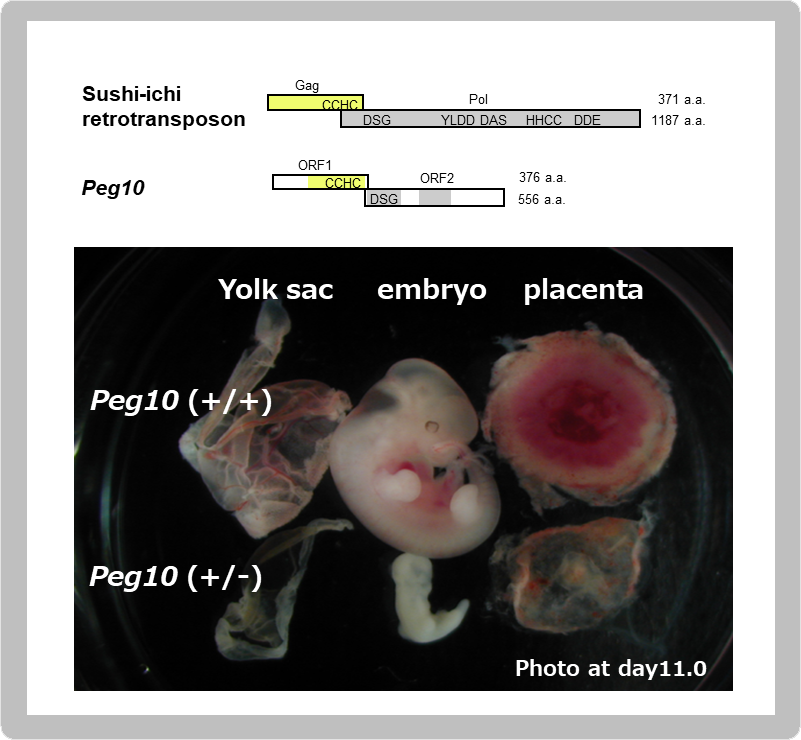
PEG10はsushi-ichiレトロトランスポゾンのGagとPolに相同性を示すタンパク質をコードし、GagのRNA結合モチーフであるCCHC配列、Polのプロテアーゼ活性中心のDSGモチーフは保存されている。また、LTRレトロトランスポゾンとレトロウイルスに存在するGag-Pol融合タンパク質を作る-1フレームシフト機構も保存されている。Peg10 KOマウスは著しい胎盤形成不全によりd9.5以降の発生が進まない(写真はd11.0)。
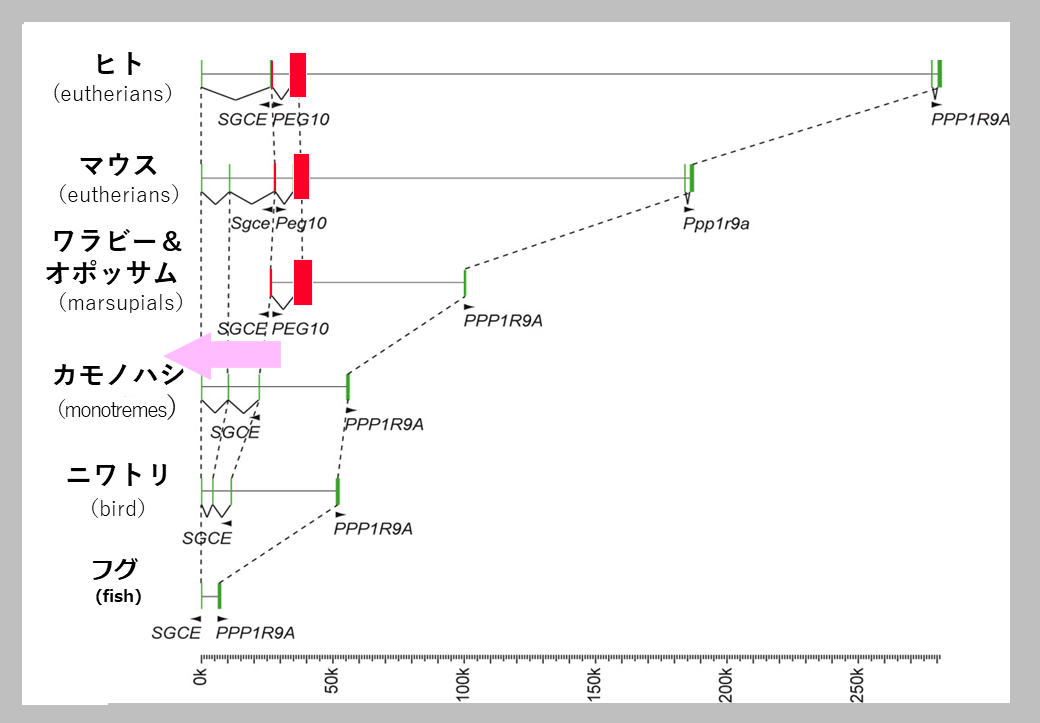
胎生の哺乳類(真獣類と有袋類)にのみPEG10は存在し、卵生の哺乳類である単孔類、卵生の鳥類、魚類のゲノムにはPEG10は存在しないことから、PEG10の獲得と胎生の開始時期は一致することがわかる。

高等脊椎動物である羊膜類(爬虫類、鳥類、哺乳類)は、個体発生時に胎児以外に4つの胚体外組織(羊膜、卵黄膜、尿膜、漿膜)を持つ。哺乳類の胎盤は、これらから派生してできた臓器であり、有袋類は卵黄嚢と漿膜が接した胎盤を、真獣類は尿膜と漿膜が結合して複雑な浸潤組織を持つ胎盤を形成する。灰色は栄養膜(トロホブラスト)細胞を表す。
参考文献
- Ono R, Nakamura K, Inoue K, Naruse M, Usami T, Wakisaka-Saito N, Hino T, Suzuki-Migishima R, Ogonuki N, Miki H, Kohda T, Ogura A, Yokoyama M, Kaneko-Ishino T* and Ishino F*. Deletion of Peg10, an imprinted gene acquired from a retrotransposon, causes early embryonic lethality. Nat Genet 38, 101-106 (2006).
5. 真獣類特異的獲得遺伝子PEG11・SIRH遺伝子群と哺乳類らしさ
マウス染色体12番遠位部のインプリント領域では母親性2倍体マウスが胎児期後期からの成長遅滞や胎児期後期・新生児致死という表現型が見られる(図2)。我々はこれが胎盤の機能異常によるものと予想し、原因インプリント遺伝子の同定を目指した。この領域のマウスゲノムを独自に解読し複数のPEGとMEGを同定したが(図3)、この中のPEG11(現在はRetrotransposon Gag-like 1, RTL1が正式名)はPEG10と同じLTRレトロトランスポゾンのsushi-ichiレトロトランスポゾンに相同性を示す遺伝子だった。この領域に関しては、ベルギーのグループからヒツジPEG11を含め同様の結果が報告された31。
Peg11/Rtl1 KOマウスでは、予想通り胎児期後期・新生児致死や成長遅滞が再現された32(図10)。胎盤には胎児毛細血管という母親と胎児の血液間での効率的な栄養・酸素交換に機能する構造があるが、KOマウスではこの構造を胎児期後期まで維持できないことが原因である32,33。この胎児毛細血管は真獣類型胎盤に特徴的な構造である(図9参照)。イギリス・オーストラリアの研究者は有袋類のこの領域にPEG11/RTL1とすべてのMEGは存在せず、インプリント制御もないことを報告した34。すなわちPEG11/RTL1はPEG10と異なり有袋類には存在しない遺伝子であるが、真獣類の長い妊娠期間を支える胎盤構造の維持に関係する真獣類特異的獲得遺伝子の良い例となった26-28。
PEG10とPEG11/RTL1のようにsushi-ichiレトロトランスポゾンのGag-Polと相同性を示すタンパク質をコードし(図11)、哺乳類特異的獲得遺伝子として機能するものはどのくらい存在するのだろうか?マウスとヒトのゲノムで網羅的に探索し、PEG10とPEG11/RTL1以外に新たに9個の候補遺伝子を同定し、全11遺伝子をsushi-ichi retrotransposon homologues (SIRH) 遺伝子群(新規遺伝子をSIRH3-SIRH11)と命名した(図11)30。異なる名称もいくつか提案されたが35,36、現在ではPEG10, LDOC1(SIRH7)以外はRTLが正式名称である。PEG10だけが唯一獣類(有袋類と真獣類)に保存され、残りは全て真獣類特異的遺伝子である37-39。
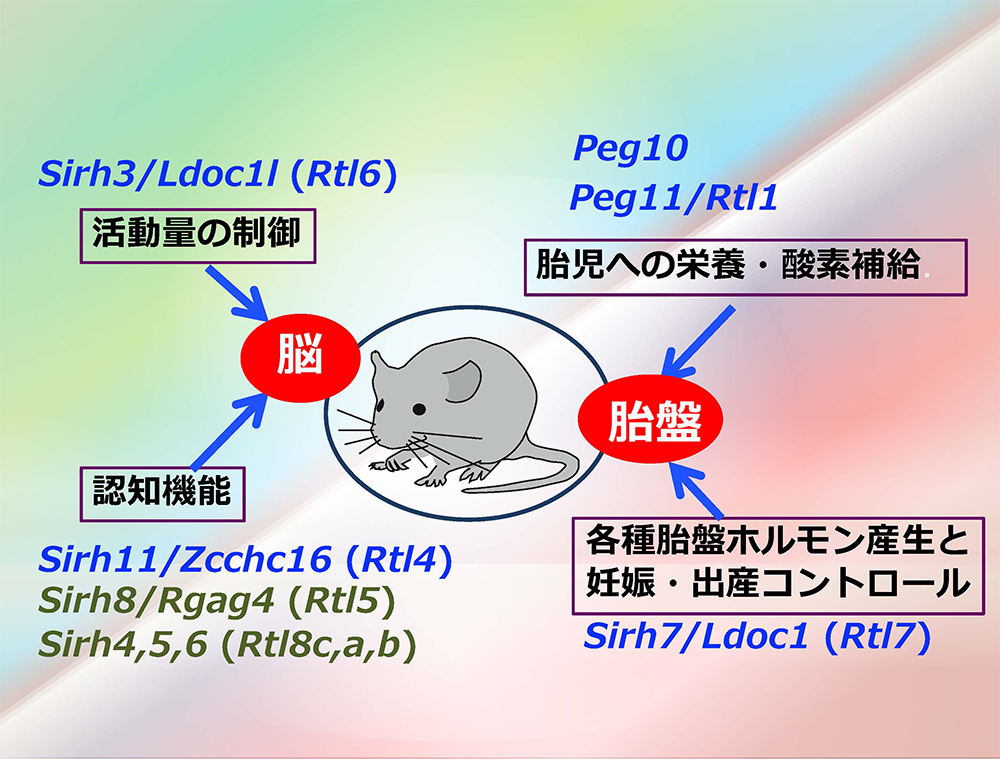
SIRH/RTL遺伝子の大部分はGagに相同性を持つ部分しかもたない小さな遺伝子である。本当に何らかの機能を持つのかどうか、KOマウスによる機能解析を順次行なった。これまでに未発表のものを含め9/11の遺伝子で機能を確認したところ、“胎盤”と“脳”で機能する2群に大別された(図12)。
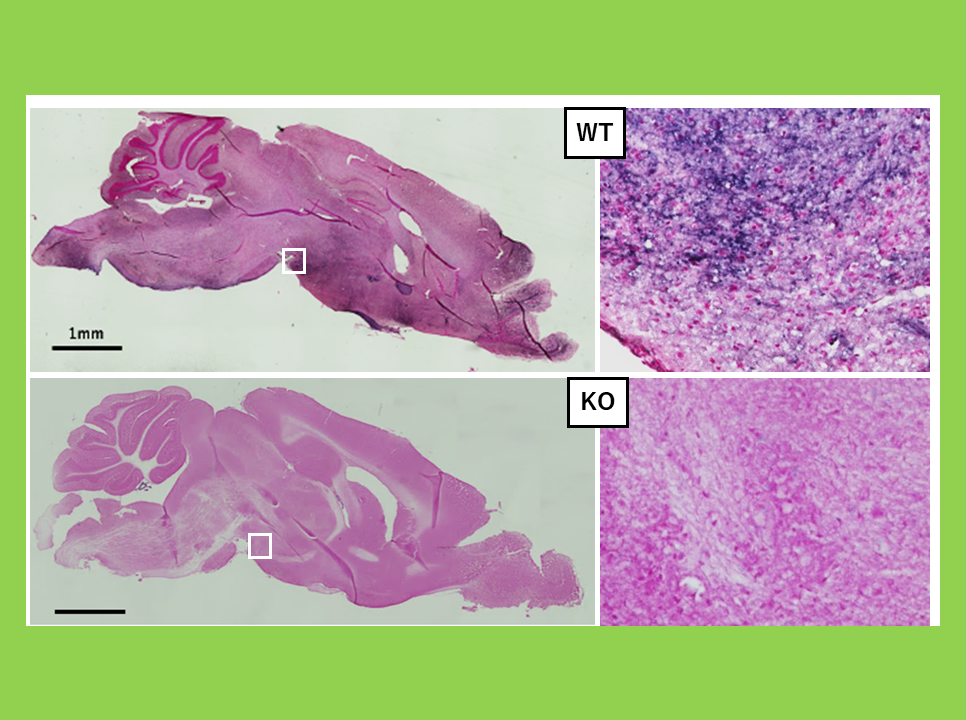
“胎盤”グループにはPeg10, Peg11/Rtl1とSirh7/Ldoc1 (Rtl17)が含まれる。胎盤の重要な機能として、胎児への栄養供給の他に妊娠維持に関わる内分泌制御がある。胎盤を構成する各種の細胞はそれぞれ異なる時期に異なる胎盤ホルモンを産生する。Sirh7/Ldoc1 KOマウスではこれらの細胞の分化・成熟の異常により胎盤構造が乱れ、ホルモン制御にも乱れが生じる(図13)。特に妊娠維持ホルモンであるプロゲステロン(P4)が分娩前に十分落ち切らないため出産遅延が引き起こされ、その結果、母親が子育てを放棄するため大部分が新生児致死になる37。
脳”グループは、KOマウスがそれぞれ異なった興味深いある行動異常を示す。Sirh11/Zcchc16 (Rtl14)(大脳皮質のノルアドレナリン蓄積量低下による新しい環境への適応不全と衝動性の昂進)(図14)38、Sirh3/Ldoc1l (Rtl6)(不安様行動の増加と活動性の低下)(論文投稿中)、 Sirh8/Rgag4 (Rtl5)(統合失調症に共通するプレパルス・インヒビション反応低下)(未発表)とSirh4,5,6 (Rtl8c,a,b)(攻撃性の更新と子育て放棄)(未発表)などがあり、ヒトの神経疾患との関係が示唆されるものもある。高度の脳機能は哺乳類の特徴の一つであり、これらは真獣類特異的遺伝子として真獣類の脳機能の進化に関係した可能性が高いと考えている(図12)。
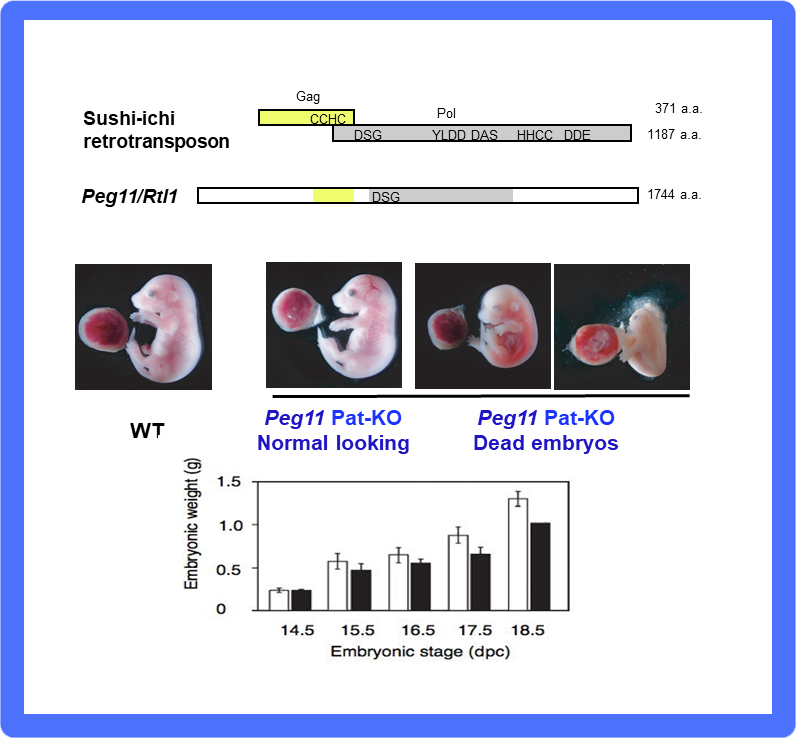
PEG11もsushi-ichiレトロトランスポゾンのGagとPolに相同性を示すタンパク質をコードし、Polのプロテアーゼ活性中心のDSGモチーフは保存されている。Peg11 KOマウスは胎盤機能形不全により胎児期後期致死性(中:写真はd16.5)や胎児期後期以降の成長遅延(下)を示す。
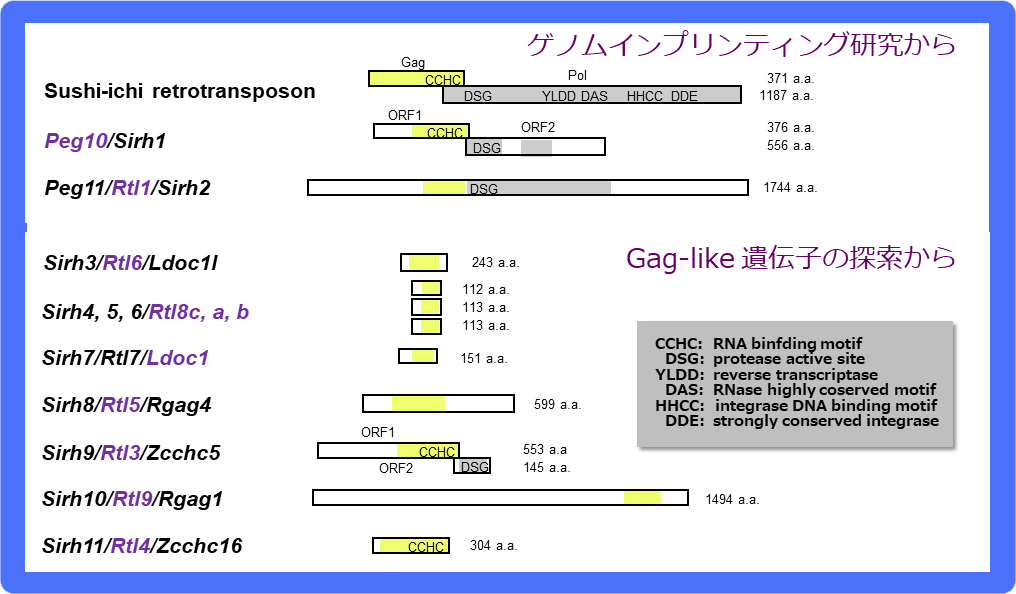
SIRH遺伝子群はsushi-ichiレトロトランスポゾンGagにタンパク質レベルで20~30%の相同性を示す。互いの相同性もそれぞれ20~30%であることから、個別の機能を持つと予想される。
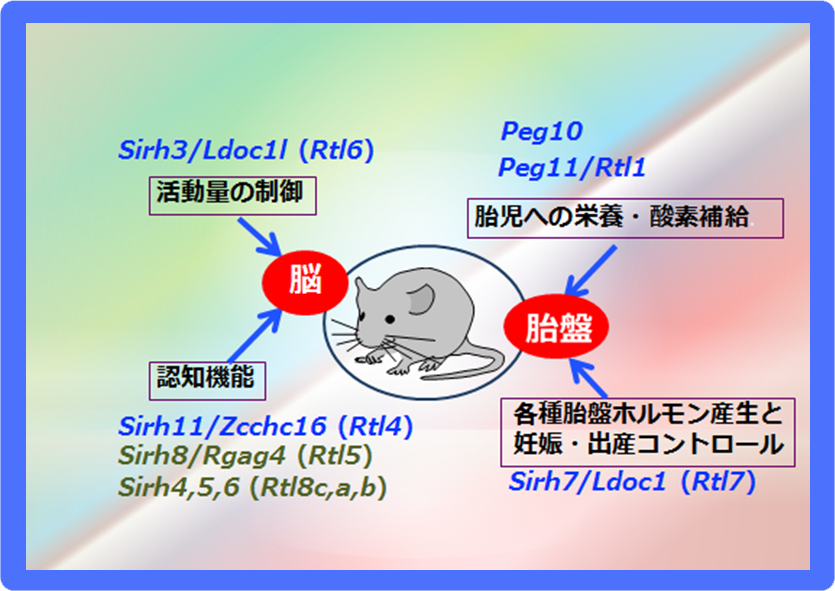
SIRH遺伝子群は胎盤や脳機能という真獣類の進化に関係した特徴を持つことから、哺乳類にとって重要な遺伝子として保存されたことがわかる。(灰色の遺伝子は未発表、Sirh9・Sirh10の機能は同定できていないため未掲載)
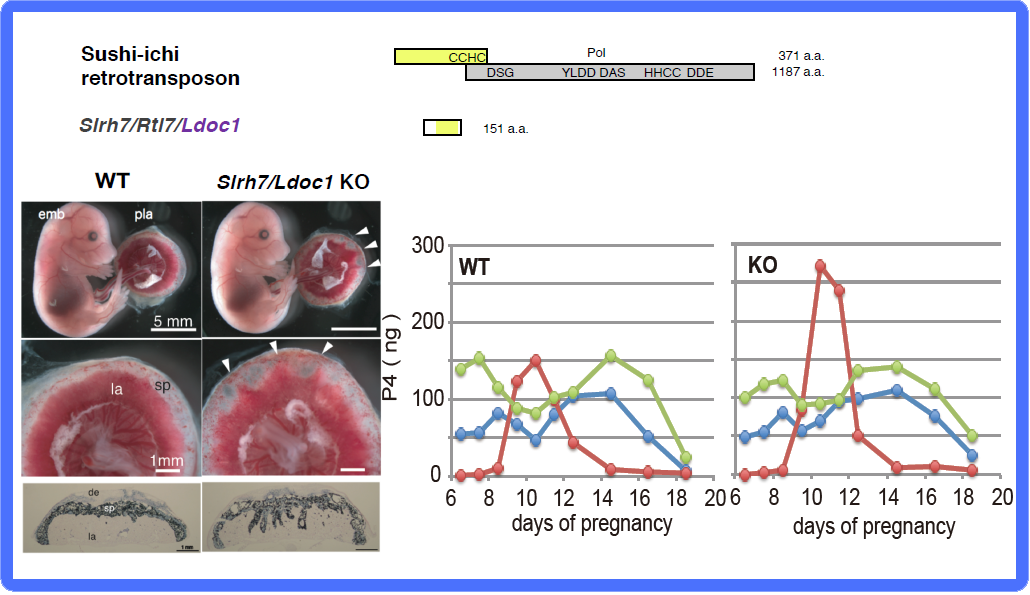
SIRH7はsushi-ichiレトロトランスポゾンGag に相同性を示す。初期胚期に将来の胎盤になる部分で高発現し、多様な胎盤細胞のすべての発生・分化に影響を与える。KOマウスでは胎盤の3層構造の乱れ(左)だけでなく、巨大栄養芽細胞層で作られるプロゲステロン(P4)の発現量の増加が見られる(右)。げっ歯類ではP4は卵巣だけで作られる(緑線)と信じられてきたが、妊娠が成立する時期に一時的に卵巣での産生が低下し、代わりに胎盤でP4が産生される(赤線)ことを我々は報告した。血中P4濃度(青線)が下がるこの時期に、胎盤で産生されるP4が妊娠維持へ機能すると考えられる。
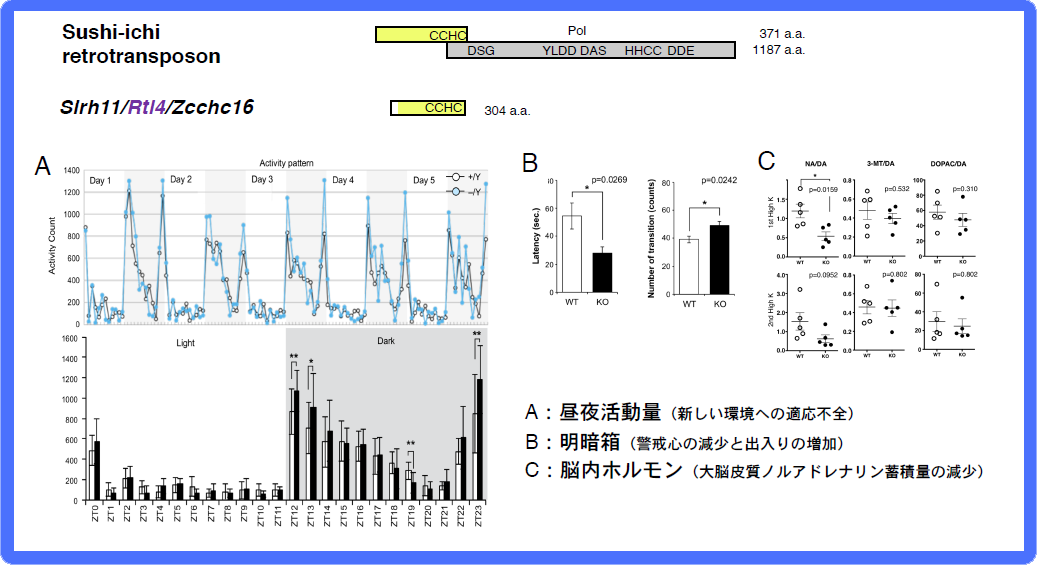
SIRH11はsushi-ichiレトロトランスポゾンGag に相同性を示し、RNA結合モチーフであるCCHCが保存されている。A. 通常のマウス(黒線)は5日間の連続飼育で環境に慣れ活動量のピークが低下するが、KOマウス(青線)は同じレベルを示す。B. 明暗箱試験では明所へ飛び出すまでの時間(潜時)が減少し、明暗の出入り回数が増加する。C.これらの行動異常は大脳皮質におけるノルアドレナリンの蓄積量の低下(黒丸)が原因と考えられる。
参考文献
- Charlier C, Segers K, Wagenaar D, Karim L, Berghmans S, Jaillon O, Shay T, Weissenbach J, Cockett N, Gyapay G and Georges M. Human–Ovine Comparative Sequencing of a 250-kb Imprinted Domain Encompassing the Callipyge (clpg) Locus and Identification of Six Imprinted Transcripts: DLK1, DAT, GTL2, PEG11, antiPEG11, and MEG8. Genome Res. 11, 850-862 (2001).
- Sekita Y, Wagatsuma H, Nakamura K, Ono R, Kagami M, Wakisaka N, Hino T, Suzuki-Migishima R, Kohda T, Ogura A, Ogata T, Yokoyama M, Kaneko-Ishino T*and Ishino F*. Role of retrotransposon-derived imprinted gene, Rtl1, in the feto-maternal interface of mouse placenta. Nat Genet 40, 243-248 (2008).
- Kitazawa M, Tamura M, Kaneko-Ishino T* and Ishino F*. Severe damage to the placental fetal capillary network causes mid to late fetal lethality and reduction of placental size in Peg11/Rtl1 KO mice. Genes Cells 22, 174-188 (2017).
- Edwards C A, Mungall A J, Matthews L, Ryder E, Gray D J, Pask A J, Shaw G, Graves J A, Rogers J, SAVOIR consortium, Dunham I, Renfree M B, Ferguson-Smith A C. The evolution of the DLK1-DIO3 imprinted domain in mammals. PLoS Biol 6, e135 (2008).
- Brandt J, Schrauth S, Veith A M, Froschauer A, Haneke T, Schultheis C, Gessler M, Leimeister C and Volff J N. Transposable elements as a source of genetic innovation: expression and evolution of a family of retrotransposon-derived neogenes in mammals. Gene 345, 101-111 (2005).
- Youngson N A, Kocialkowski S, Peel N and Ferguson-Smith A C. A small family of sushi-class retrotransposon-derived genes in mammals and their relation to genomic imprinting. J Mol Evol 61, 481–490 (2005).
- Naruse M, Ono R, Irie M, Nakamura K, Furuse T, Hino T, Oda K, Kashimura M, Yamada I, Wakana S, Yokoyama M, Ishino F* and Kaneko-Ishino T*. Sirh7/Ldoc1 knockout mice exhibit placental P4 overproduction and delayed parturition. Development 141, 4763-4771 (2014).
- Irie M, Yoshikawa M, Ono R, Iwafune H, Furuse T, Yamada I, Wakana S, Yamashita Y, Abe T, Ishino F* and Kaneko-Ishino T*. Cognitive function related to the Sirh11/Zcchc16 gene acquired from an LTR retrotransposon in eutherians. PLoS Genet 11:e1005521 (2015).
- Ono R, Kuroki Y, Naruse M, Ishii M, Iwasaki S, Toyoda A, Fujiyama A, Shaw G, Renfree M B, Kaneko-Ishino T* and Ishino F*. Identification of SIRH12, a retrotransposon-derived gene specific to marsupial mammals. DNA Res 18, 211-219 (2011).
6. ゲノムインプリンティングと獲得遺伝子からみる生物進化
なぜ、哺乳類では発生に重要な遺伝子が片親性発現という生存に不利な機構が維持されているのだろうか?両親由来の2本のゲノムから遺伝子発現をすることは、劣性遺伝病の発症を防ぐ機構として2倍体の生物に有益であるため、ゲノムインプリンティングは一見すると、有利なものが生き残ると考えるダーウィン進化論とは矛盾する機構に見える17, 27, 28。
我々はゲノムインプリンティングのきっかけがゲノム防御機構であると考えていたが、この考えは制御領域であるDMRが外来DNA配列に由来するという事実から支持される24-28。しかし、ゲノムインプリンティングの重要性はむしろ、結果として片親性遺伝子発現自体が個体発生に必須な機構となっている点にある。例えば図4のインプリント領域の場合、インスレータ機能を持つ外来DNA配列の挿入により上流の遺伝子が発現できない状況になる。防御反応により外来DNA配列をDNAメチル化した場合、上流の遺伝子の発現が誘導される代わりに、インスレータ配列に近接する遺伝子の発現が抑制される。すなわち、挿入によって生じたゲノム配列の構造上の変化により、1本の染色体から挿入部位周辺の遺伝子をすべて発現することは不可能になる。機能を失う遺伝子が生じてしまうのである。この場合、挿入部位のメチル化の有無を変えて(DMR状態にする)、その領域のすべての遺伝子を父親・母親由来のゲノムからPEGとMEGに分けて片親性で発現できれば、個体の生存には有利な状況が生まれるであろう。
この片親性発現による危機回避が哺乳類に広くゲノムインプリンティング機構が保存される理由と考え、我々は相補仮説(Complementation hypothesis)として提唱している17,27,28。いわば、片親性発現は致死から個体を守るための “進化上のトレードオフ” と言えるだろう27,28。
ゲノム防御機構を起源としたゲノムインプリンティングは、父親由来・母親由来のゲノムの1)相補性(コンプリメンテーション)の獲得により哺乳類に必須の機構となり、2)競合(コンフリクト)によるPEGとMEGの選択が胎生への適応として加わったと考えられる。
一方の獲得遺伝子はまさにダーウィン進化論の非常に良い例と言える。ダーウィンは自然選択により“種の起源”を説明したが、SIRH遺伝子は獲得された後、正の淘汰を受けた遺伝子として集団内に広がり、有袋類と真獣類の形成につながったと考えられるからである(図15A、B)27,40,41。
自然選択では個体間の競争の重要性が強調されるが、確かに一つ一つの遺伝子について考えると、まさにこのスキームが成り立っている。しかし、真獣類の成立には多くの獲得遺伝子が関わった事実を考えると、遺伝子獲得をした1個体の系列に次々に遺伝子獲得を繰り返すモデル(図16A)以外に、複数の個体に独立に獲得された遺伝子が集団間の交配によって集積されるモデルのように個体間の協調が重要性をもつ自然選択の形も見えてくる(図16B)41。
多数の個体の存在は、その集団に多数の有益な変異を生み出し、交配でより良い組み合わせを生み出す可能性を高めている。集団の未来の可能性を支えているのは集団の多様性である。ダーウィン進化論では、個体間の競争(コンペティション)に加えて協調(コーポレーション)も重要な意味を持つと考えられる。
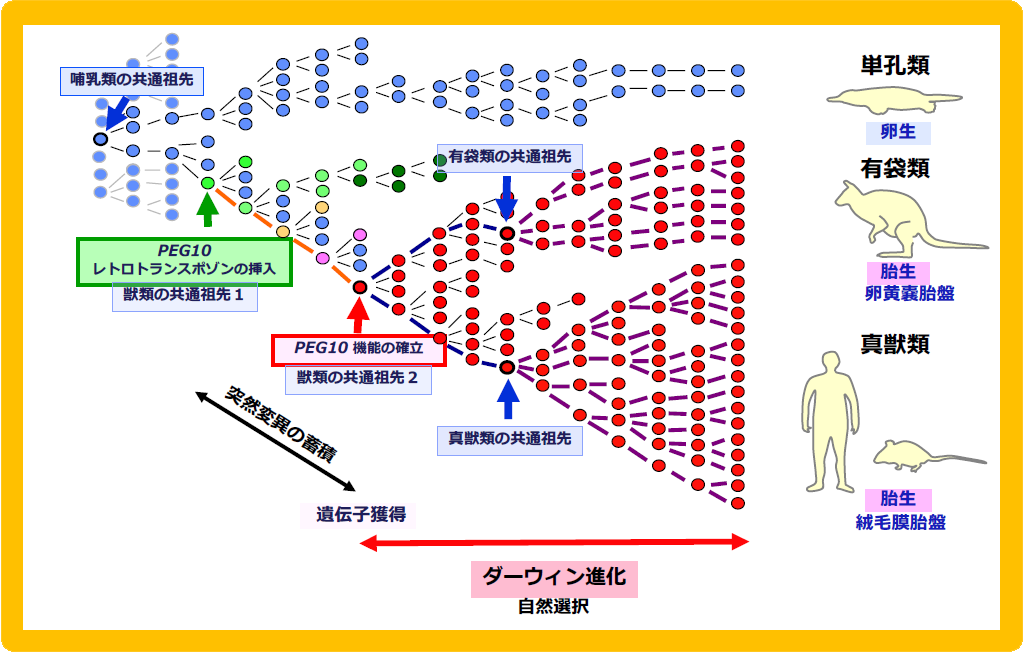
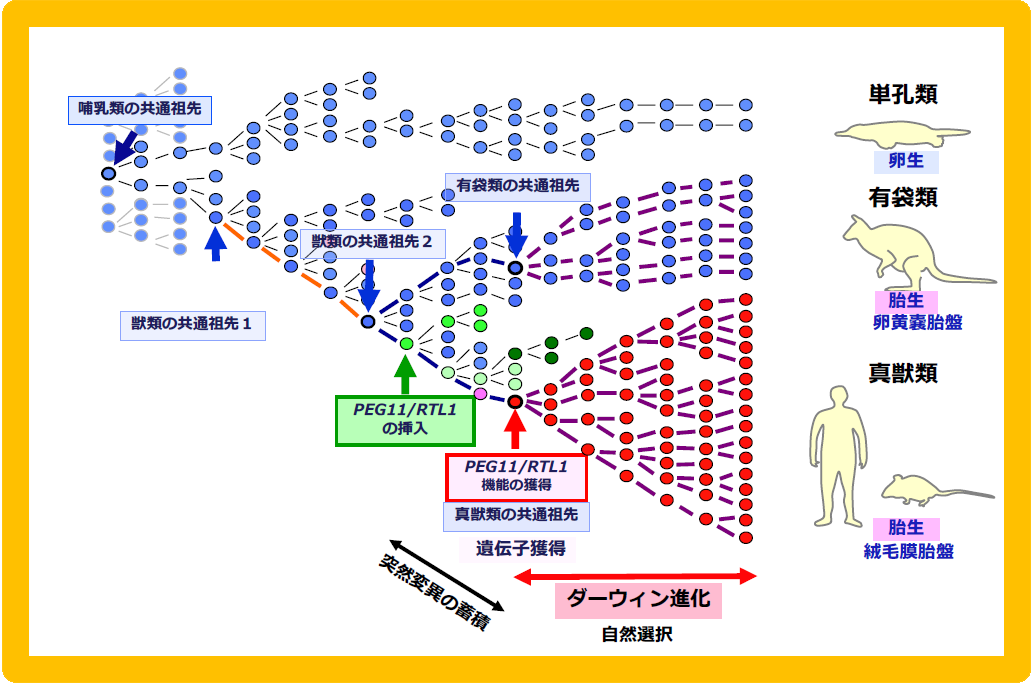
A. PEG10の場合:単孔類と分岐した後、獣類の共通祖先ゲノムに挿入されたLTRレトロトランスポゾン配列が、有袋類と真獣類の分岐前に機能を獲得して選択され、この2つのグループに広がった。B. PEG11:有袋類と真獣類の分岐後に、真獣類の共通祖先ゲノムに挿入され、機能を獲得した後、選択され真獣類すべてに広がった。SIRH3-11遺伝子の場合も同様のスキームが成り立つが、真獣類が4系統に別れた後、機能を失ったケースもある(SIRH11は南アメリカ起源の異節類では偽遺伝子化している)。
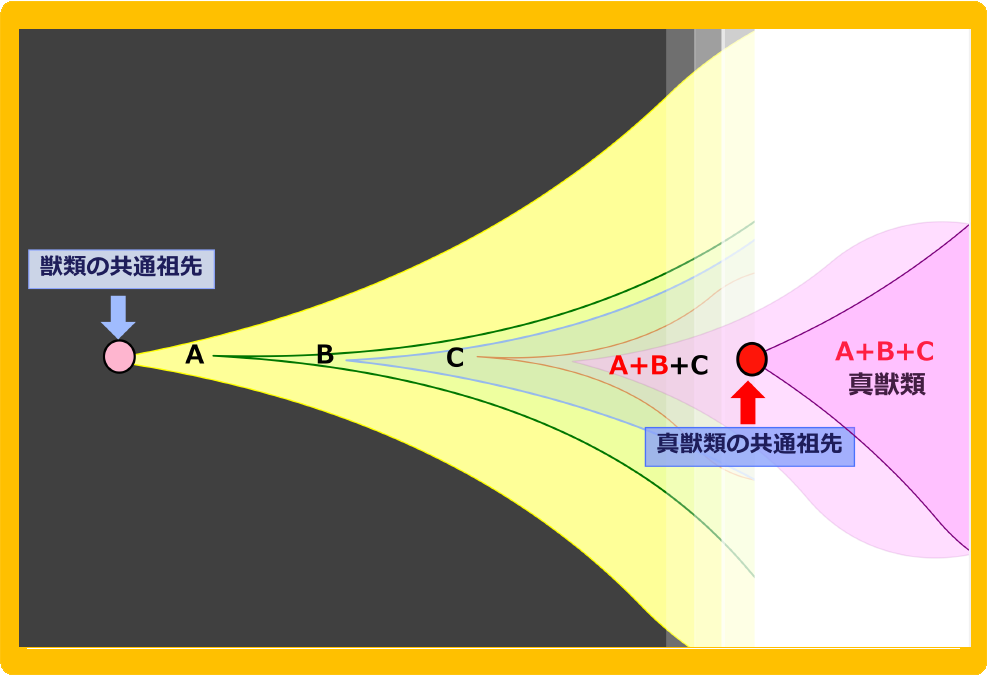
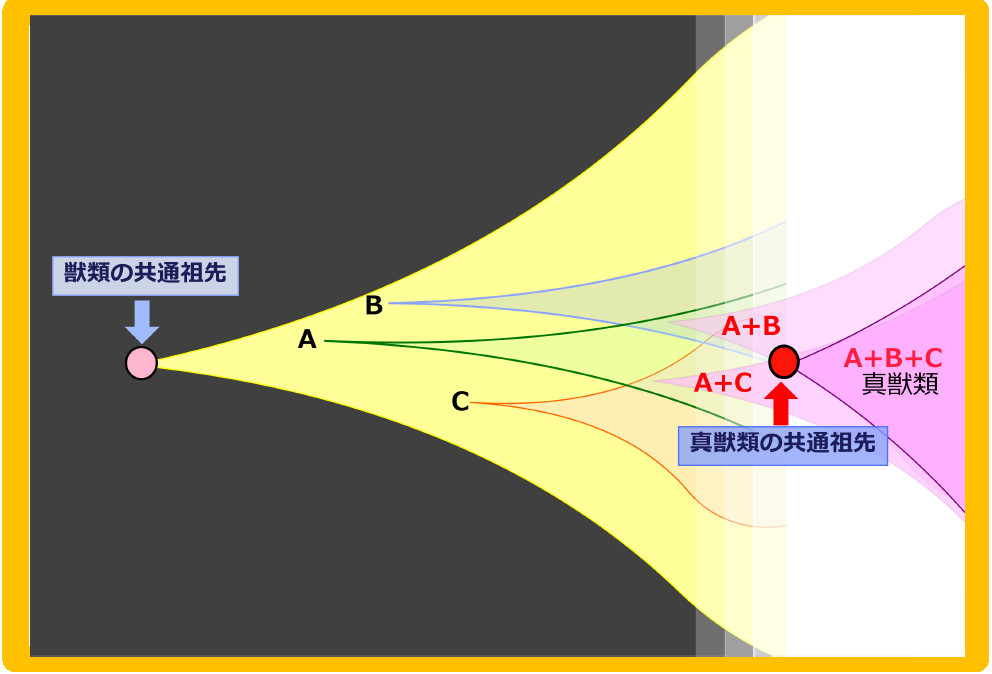
PEG11と9個のSIRH遺伝子群は真獣類でどのように獲得されたのか? A. 有袋類との分岐後、真獣類の共通祖先につながる1つの系統で、順番に挿入され機能獲得して選択されたモデル B. 有袋類との分岐後、複数個体に挿入され機能獲得された各々の遺伝子が、集団間の交配を通じて1つの系統に集まることにより真獣類の共通祖先が生じるモデル。どちらのモデルも獲得遺伝子が自然選択により正の選択を受けるダーウィン進化のスキームにあてはまる。
参考文献
- Kaneko-Ishino T and Ishino F. Retrotransposon silencing by DNA methylation contributed to the evolution of placentation and genomic imprinting in mammals. Develop Growth Differ 52, 533-543 (2010).
- Kaneko-Ishino T and Ishino F. Cooperation and Competition in Mammalian Evolution -Gene Domestication from LTR Retrotransposons- In Evolution, Origin of Life, Concepts and Methods, Chapter 15 (Ed. Pontarotti P), Springer Nature, pp.317-333 (2019).
7. PEG11/RTL1は真獣類の胎生機構への対応や脳機能の発達にも関係した
哺乳類らしさの構築にPEG11/RTL1が重要な貢献した2つの新しい証拠が加わった。第5章ではPEG11/RTL1が胎盤機能の維持に関わることを紹介したが、今回、胎児期及び新生児期特異的に筋肉発生に関わること42、脳神経系の発達にも重要な機能を持つことを明らかにした43。これはPEG11/RTL1が真獣類の胎生機構への適応や真獣類の運動・感覚系の神経機能の向上に関係した証拠と考えられる。
発見の発端になったのは鏡−緒方症候群 (KOS14)、テンプル症候群 (TS14)と呼ばれるヒトのゲノムインプリンティング疾患である(図17)。これらはヒト染色体14番染色体の父親性・母親性二倍体で発症する症候群で、特に、鏡−緒方症候群は日本では難病指定されている非常に重篤な疾患である。ベル型肋骨という奇形を特徴とし、呼吸不全による新生児致死や、腹直筋断裂などの筋肉疾患、胎盤過形成や羊水過多などの妊娠中の異常、出生後の呼吸管理で生きることができたとしても知的発達障害、摂食障害を伴う成長遅滞などの精神・神経疾患を呈することが知られている。一方、テンプル症候群は出生前及び出生後の成長遅滞、筋緊張低下、摂食障害、発語の遅れ、軽度の知的障害、思春期の早発などが見られる。それぞれ症状は異なるものの、どちらにも胎盤、筋肉、脳神経系の異常が見られる。
2008年に私たちはマウスモデルで、Peg11/Rtl1の欠失により胎盤の胎児毛細血管の機能を維持できないために、出生前の成長遅滞や胎仔期後期致死を引き起こすこと、一方でPeg11/Rtl1の過剰発現も胎盤の胎児毛細血管の異常を引き起こすことを明らかにした32。モデルマウスを用いたPeg11/Rtl1の欠失と過剰は、それぞれテンプル症候群の出生前の成長遅滞、鏡−緒方症候群の胎盤過形成に相当するため、PEG11/RTL1が2つの症候群における胎盤異常の原因遺伝子であると報告した32。鏡−緒方症候群のべル型肋骨や致死性、知的発達障害については、マウスの筋肉や脳ではPeg11/Rtl1発現が見られなかったため、長い間原因が解明できなかった。
しかし、これらの報告から10年が過ぎて、Peg11/Rtl1の特異的抗体を用いてマウスの筋肉や脳を調べ直したところ、胎仔期・新生仔期特異的に筋肉でPEG11/RTL1タンパク質が発現していることに気づいた。 mRNAの発現はRT-PCR のサイクル数30回で検出される程度の非常に低レベルの量であった42。離乳後(3~4週令)以降では全く検出されないため、離乳期や成体のマウスの筋肉をいくら調べてもPeg11/Rtl1が検出できなかった理由も明らかになった。
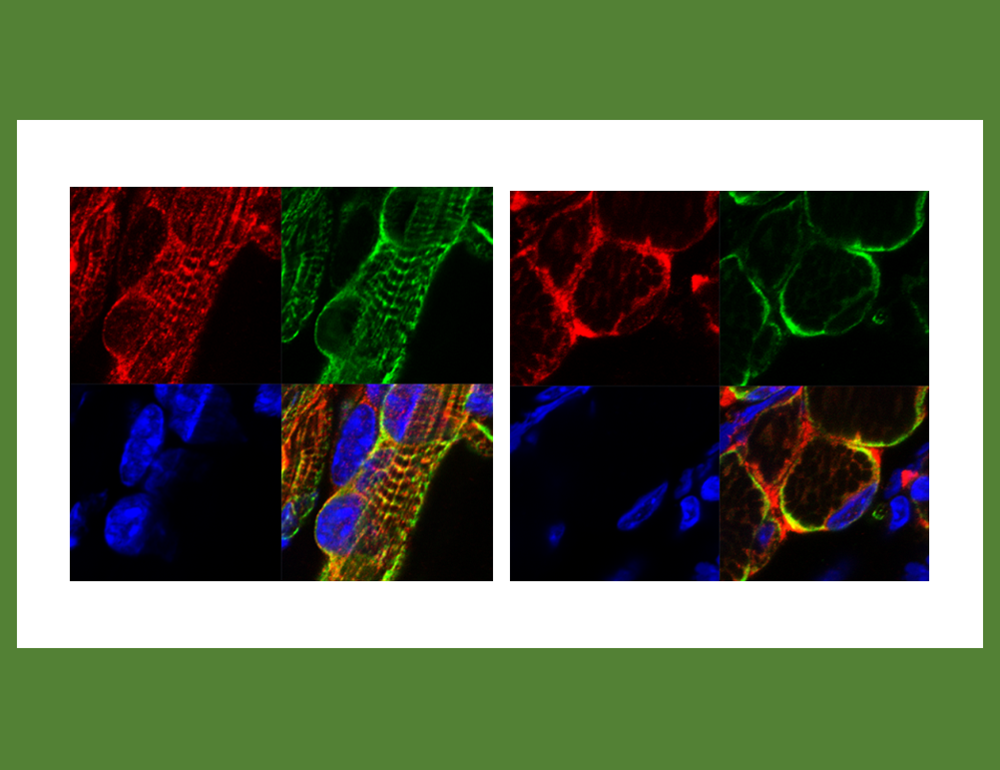
マウスの発生過程を見てみると筋肉発生が起こるごく初期から胎児でPEG11/RTL1タンパク質の発現が確認される。筋肉の幹細胞であるサテライト細胞(衛星細胞)でも発現し、この細胞の成長速度にも影響していた。重要なことは四肢の筋肉よりも、呼吸に関係する肋間筋、腹筋、横隔膜でPeg11/Rtl1発現欠失、発現過剰の影響が大きく見られたことで、これが鏡−緒方症候群における呼吸不全を伴う新生児致死や腹直筋開裂、テンプル症候群の筋緊張低下などの原因であると考えられた(図18)42。筋細胞内ではデスミンという細胞内骨格として筋繊維の束を核膜、細胞膜に固定する機能を持つタンパク質44と共染色され、サルコメア構造のZバンドに存在することが明らかになった(図19)42。
脳でのPEG11/RTLタンパク質発現は、新生仔の筋肉を調べていた際に、脊髄の神経繊維が特異的抗体で染まることで気がついた。調べてみるとPeg11/Rtl1 mRNAは筋肉よりもさらに低いレベルで脳や脊髄で発現していた(PCRのサイクル数で32~35回)。免疫染色では大脳皮質の第5層から脊髄に向かう運動神経(皮質脊髄路の全体)が綺麗に染まり、脳梁や海馬交連、前交連という左右の脳半球の同じ皮質部位をつなぐニューロンである交連繊維や、海馬采、脳弓という海馬記憶の外部出力経路や内側扁桃核という情動反応と記憶を司る部分もシグナルが検出された(図20)43。また、第6層から視床への感覚神経にも発現が確認されている。 これらの部位の機能障害は、鏡−緒方症候群、テンプル症候群に見られる運動性障害や知的発達遅延などの神経障害の原因となり得ると考えられた。また呼吸不全、摂食障害や発語の遅れなども筋肉の異常だけでなく、それらを神経支配する神経細胞側の異常が合わさった症状である可能性があり、鏡−緒方症候群、テンプル症候群は神経疾患と神経・筋疾患の両面があることが示唆された。マウスの行動解析でも著しい運動性の低下と不安様行動の亢進が観察されているが、マウスの行動異常と鏡−緒方症候群・テンプル症候群における疾患症状を直接対応させることは難しい。しかし、ヒトでも脳内におけるPEG11/RTLタンパク質の発現部位が同様であれば、脳の機能障害の有力な説明となるだろう。
進化的視点から見ると、皮質脊髄路は哺乳類だけに、脳梁は真獣類だけに見られる脳内構造である。哺乳類でも有袋類より真獣類の方が、手指運動の器用さが発達していることが知られている46, 47。PEG11/RTL1タンパク質がこの2つの構造で発現していることは実に興味深い。脳梁は大脳皮質の同じ部位を直接結び左右半球の情報交換の速度を改善することで運動機能の進化に関与したと考えられている(図21)43。PEG11/RTL1タンパク質の機能が加わることで皮質脊髄路自体の機能も亢進した可能性があるかもしれない。PEG11/RTL1タンパク質は神経細胞の軸索部分で発現しており、ミエリン鞘のようにこれが神経伝達速度に影響を与えているのかもしれない。脳梁形成にも関わるのか?という問題も提起され、新しい脳内構造の誕生の秘密が明らかにできるかもしれない。真獣類特異的獲得遺伝子PEG11/RTL1が脳機能に関与するという発見は、真獣類の脳機能進化を明らかにする上で重要な意味を持つであろう。
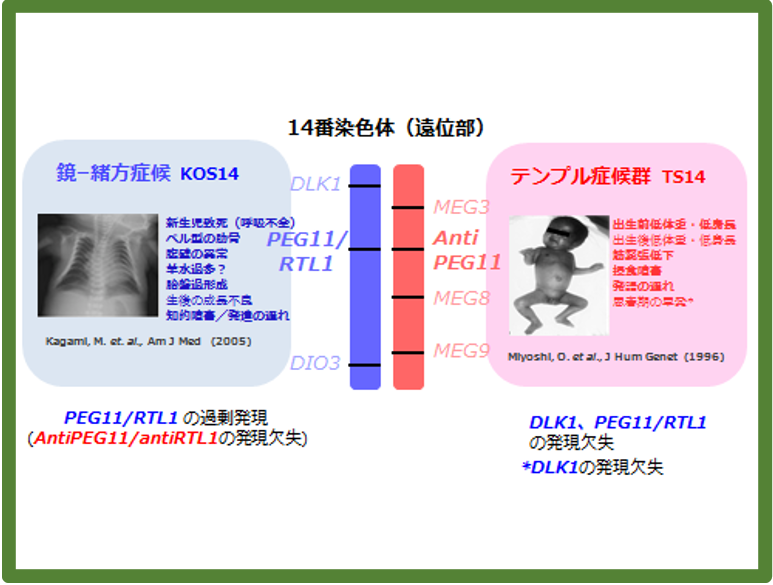
ヒト14番染色体のゲノムインプリント領域はタンパク質をコードする3つのPEG (DLK1, PEG11/RTL1, DIO3) とノンコーディングRNAである4つのMEG (MEG3, AntiPEG11/antiRTL1, MEG8, MEG9) から構成される。通常、父親性2倍体の染色体異常では、その染色体領域に含まれるPEGの発現が2倍になり、MEGの発現が無くなる。しかし、この領域には、さらに特殊な要因が加わっている。それがPEG11/RTL1の発現制御様式である。PEG11/RTL1のアンチセンスに当たるAntiPEG11/antiRTL1には6つのmiRNAが含まれ、PEG11/RTL1 mRNAを標的として分解する。PEG11/RTL1の発現量はAntiPEG11/antiRTL1で制御されるため、AntiPEG11/antiRTL1の欠失はPEG11/RTL1の4~6倍の過剰発現を引き起こす。鏡―緒方症候群の場合、父親由来ゲノム2本に対して母親由来ゲノムが無いので、PEG11/RTL1量は4〜6倍となる。この過剰発現がこの疾患の胎盤、筋肉、脳における異常の全てに関わっていることが明らかになった。
テンプル症候群の場合、出生前後の成長不良に関してはPEG11/RTL1とDLK1の両方の欠失が関与すると考えられる。一方、思春期の早発はDLK1の欠失によると考えられるが、筋肉関係の異常と脳神経系の異常のほとんどはPEG11/RTL1の欠失が原因と考えられる。
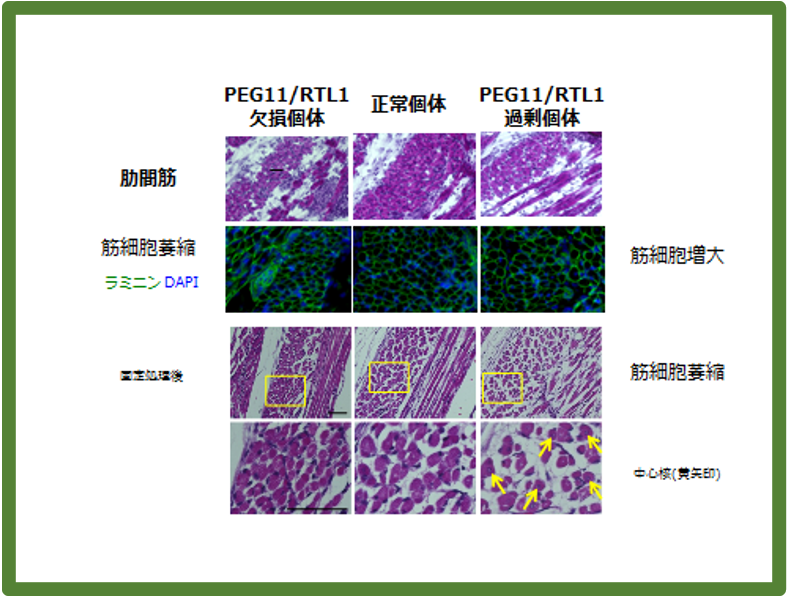
Peg11/Rtl1の欠失マウス(左)では筋細胞の直径が小さくなり、過剰発現マウス(右)では逆に大きくなっている。しかし、後者は固定処理を行うと細胞内の筋繊維束が収縮し、細胞膜との間に大きな隙間が生じる。これは筋細胞内に起きている構造異常を示唆する。また中心核の存在は筋細胞の未熟性を示している。筋細胞の強度は、欠失、過剰発現のどちらの場合でも弱くなっていると考えられる。
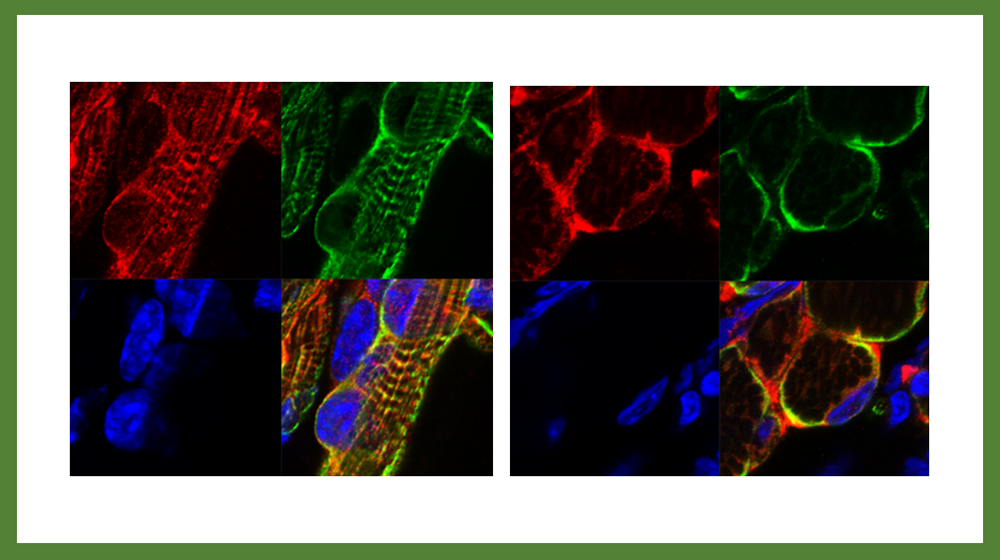
PEG11/RTL1とDESMINタンパク質はサルコメア構造のZバンド上に共局在し、蛍光染色像は横紋パターンを示す。

新生児脳においてPEG11/RTL1タンパク質は大脳皮質5層から脊髄に至る複数の運動ニューロン(錐体経路)で発現している。皮質脊髄路は脊髄までを直接結ぶ経路であるが、これは哺乳類になって生じた新しい脳の神経経路である。左右の脳半球を結ぶ脳梁、海馬交連、前交連でも発現が見られるが、脳梁は真獣類になって生じた新しい脳構造で、この構造の誕生は真獣類の脳機能の向上に寄与したと考えられている。また、海馬からの出力経路や内側扁桃核といった記憶・情動に関わる部位にも発現が観察された。

新生児脳においてPEG11/RTL1タンパク質は大脳皮質第5層、第6層で強く発現し、そこから出る脳梁繊維が左右半球を結んでいる。赤はPEG11/RTL1、緑は大脳皮質第5層マーカーのCTIP2を示す。新生児脳の脳梁では大脳皮質第5層、第6層間を結ぶニューロンが主となっているが、成体では、第2層、第3層に由来するニューロンが大部分を占める。
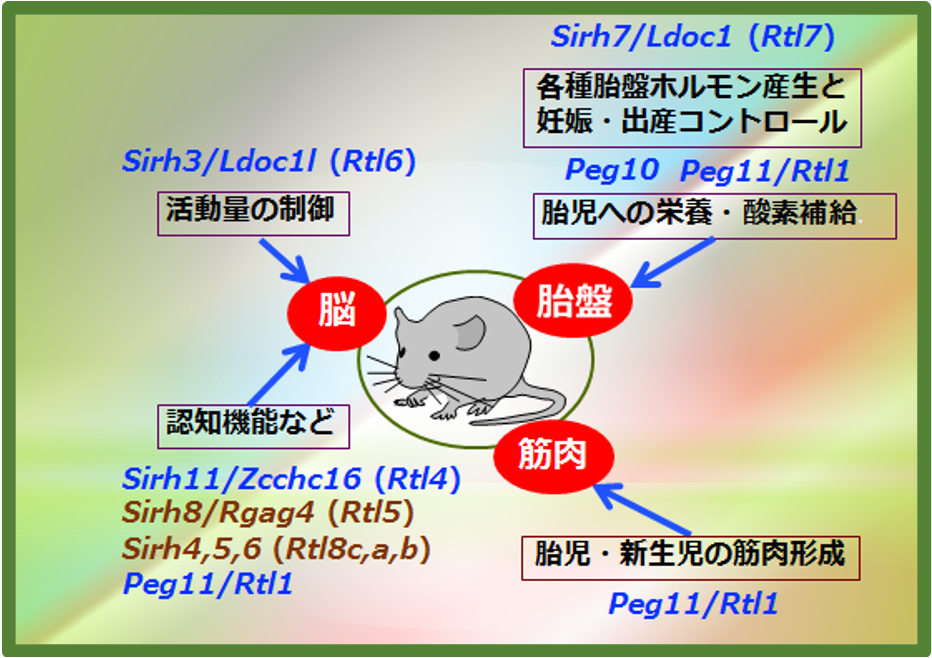
SIRH遺伝子群は胎盤や脳機能に加えて、筋肉形成にも関わっていた。
参考文献
- Kitazawa M, Hayashi S, Imamura H, Takeda S, Oishi Y, Kaneko-Ishino T and Ishino F. Deficiency and overexpression of Rtl1 in the mouse cause distinct muscle abnormalities related to the Temple and Kagami-Ogata syndromes. Development 147:dev185918 (2020) doi: 10.1242/dev.185918.
- Kitazawa M, Sutani A, Kaneko-Ishino T and Ishino F. The role of eutherian-specific RTL1 in the nervous system and its implications for the Kagami-Ogata and Temple syndromes. Genes Cells (2021) doi: 10.1111/GTC.12830
- Goldfarb LG and Dalakas MC. Tragedy in a heartbeat: malfunctioning desmin causes skeletal and cardiac muscle disease. J Clin Invest 119, 1806-1813 (2009).
- Milner DJ, Weitzer G, Tran D, Bradley A and Capetanaki Y. Disruption of muscle architecture and myocardial degeneration in mice lacking desmin. J Cell Biol 134, 1255-1270 (1996).
- Ivanco TL, Pellis SM and Whishaw IQ. Skilled forelimb movements in prey catching and in reaching by rats (Rattus norvegicus) and opossums (Monodelphis domestica) relations to anatomical differences in motor systems. Behavior Brain Res, 79, 163–181 (1996).
- Frost SB, Milliken GW, Plautz EJ, Masterton RB and Nudo RJ. Somatosensory and motor representations in cerebral cortex of a primitive mammal (Monodelphis domestica): A window into the early evolution of sensorimotor cortex. J Comp Neurol, 421, 29–51 (2000).
8. 神経細胞(ニューロン)で発現し脳を操るSirh4, 5, 6/Rtl8c, a, b
ニューロンで機能する遺伝子としてヘッドライン7で紹介したKagami-Ogata症候群、Temple症候群の原因遺伝子になっているPEG11がある。最近、PEG10もニューロンで発現し、ヒト疾患への関与が示唆されているが1,2、われわれも脳特異的ノックアウト(KO)マウス に大きな異常を確認している(志浦 未発表データ)。このニューロンで機能するグループには、X染色体上に3つの相同遺伝子のクラスターとして存在しているSirh4, 5, 6/Rtl8c, a, bも加わる3。ヒトや他の真獣類種でも多くの場合、3つの遺伝子クラスターとして存在しているが、生物学的な機能やなぜ3つの遺伝子として存在しているのか?という問題は長い間、不明であった。
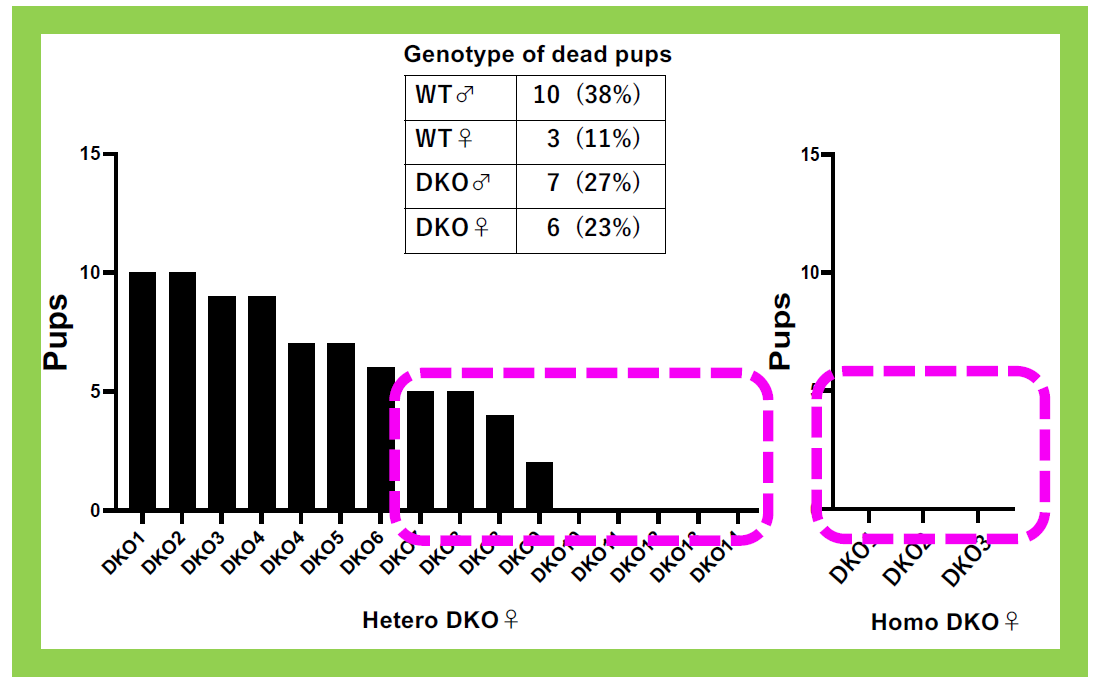
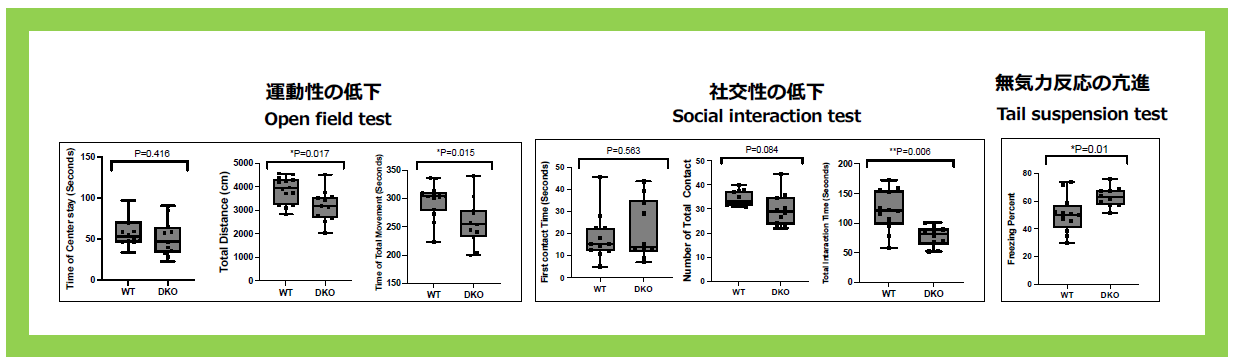
Sirh4/Rtl8cを単独でKOしても、明確な異常は現れなかったが、Sirh5, 6/Rtl8a, bの2つを欠失させたdouble KO (DKO)マウスは、成体期の初期(8週目)から食事量の増加と肥満傾向が見られた(図23)。また、ヘテロDKOのメスマウスの半数、ホモDKOのメスマウスでは全例が子育てに問題があり、産んだ子供はほぼ全滅してしまう。里親に育てさせると子供は問題なく育つので、これは母親側の問題である(図24)。Sirh4, 5, 6/Rtl8c, a, bは子育てに必須な機能を持つ真獣類にとって重要な遺伝子であると考えられる。網羅的な行動解析から、運動機能の低下、社交性の低下、無気力状態の亢進という行動異常が見られるなど、脳機能の異常が観察された(図25)。これはプラダー・ウィリー症候群(PWS)という染色体15番q11-q13の母親性2倍体で発症するゲノムインリンティング疾患の後期症状と似ている。現在、この疾患との関係を追求している3。
最近、アンジェルマン症候群(AS)4というゲノムインリンティングが関係した精神発達障害の患者さんから分離したiPS細胞を神経細胞に分化させると、RTL8とPEG10タンパク質が過剰に蓄積していることが報告された1。ASはPWSと同じ染色体15番q11-q13の父親性2倍体で発症するが、その原因は母親性発現インプリンティング遺伝子のUBE3A(ubiquitin E3 ligase A)の発現がなくなることである4。UBE3Aタンパク質はユビキチン化酵素であり、RTL8とPEG10タンパク質を直接の標的として認識し、分解させる方向に向けていることがわかった。これから考えるとPWSでは母親性染色体の2倍体化によってUBE3Aタンパク質が過剰に発現するため、RTL8タンパク質量は低下すると考えられ、我々のSirh5, 6/Rtl8a, b DKOマウスでのRTL8の減少はPWSの状況とよく一致する。X染色体(Xq26)というPWSの原因領域とは全く無関係の場所にあるRTL8A, B, C遺伝子であるが、UBE3Aの標的ということでつながりがあり、より直接の疾患発症の原因になると考えられる。ちなみにRTL8を含むXq26-q28の転座によるPWSとよく似た症状も報告されている5(Florez et al. Am J Med Genet 2003)。
注)RTL8A, B, Cのように大文字アルファベット斜体はヒトの遺伝子、マウスはRtl8a, b, cのように1文字目のみ大文字の斜体、大文字立体RTL8A, B, Cはヒト・マウスの区別なくタンパク質を表す。
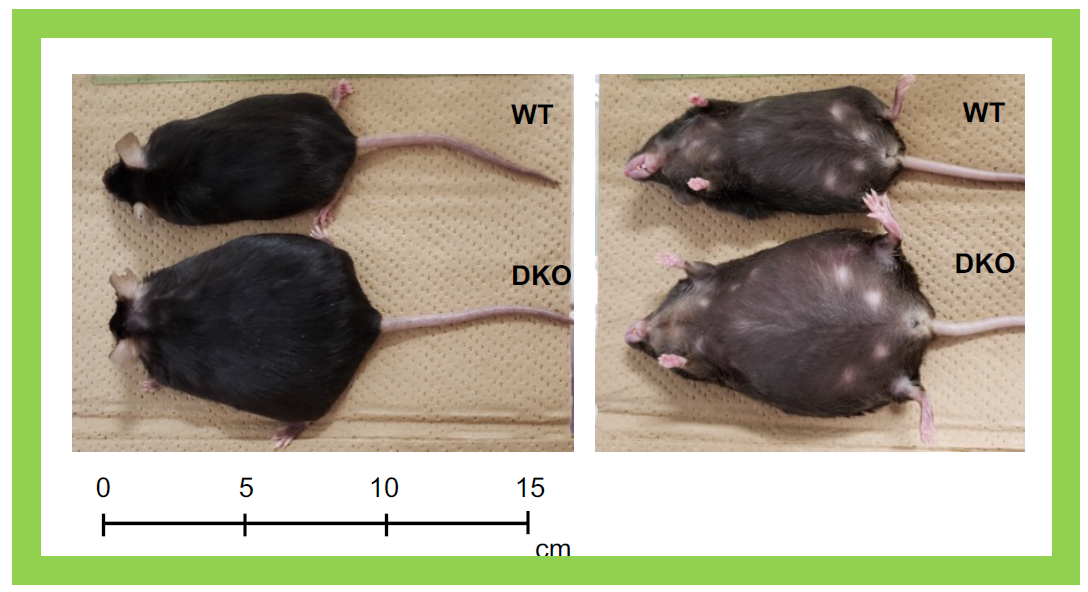
80週のメス(WT 34g, DKO 75g)
- Pandya NJ, Wang C, Costa V, Lopatta P, Meier S, Zampeta FI, Punt AM, Mientjes E, Grossen P, Distler T et al. Secreted retrovirus-like GAG-domain-containing protein PEG10 is regulated by UBE3A and is involved in Angelman syndrome pathophysiology. Cell Rep Med 2:100360 (2021).
- Black HH, Hanson JL, Roberts JE, Leslie SN, Campodonico W, Ebmeier CC, Holling GA, Tay JW, Matthews AM, Ung E, Lau CI and Whiteley AM. UBQLN2 restrains the domesticated retrotransposon PEG10 to maintain neuronal health in ALS. Elife12:e79452 (2023).
- Fujioka Y, Shiura H, Ishii M, Ono R, Endo T, Kiyonari H, Hirate Y, Ito H, Kanai-Azuma M, Kohda T, Tomoko Kaneko-Ishino T and Ishino F. Targeting of retrovirus-derived Rtl8a/8b causes late-onset obesity, reduced social response and increased apathy-like behavior. Open Biol 15: 240279 (2025).
- Nicholls RD and Knepper JL. Genome organization, function, and imprinting in Prader-Willi and Angelman syndromes. Annu Rev Genomics Hum Genet 2, 153–175 (2001).
- Florez L, Anderson M and Lacassie Y. De novo paracentric inversion (X)(q26q28) with features mimicking Prader–Willi syndrome. Am J Med Genet 121A, 60–64 (2003).
9. 脳の免疫細胞(ミクログリア)で発現し脳を護るSirh3, 8, 10, 11
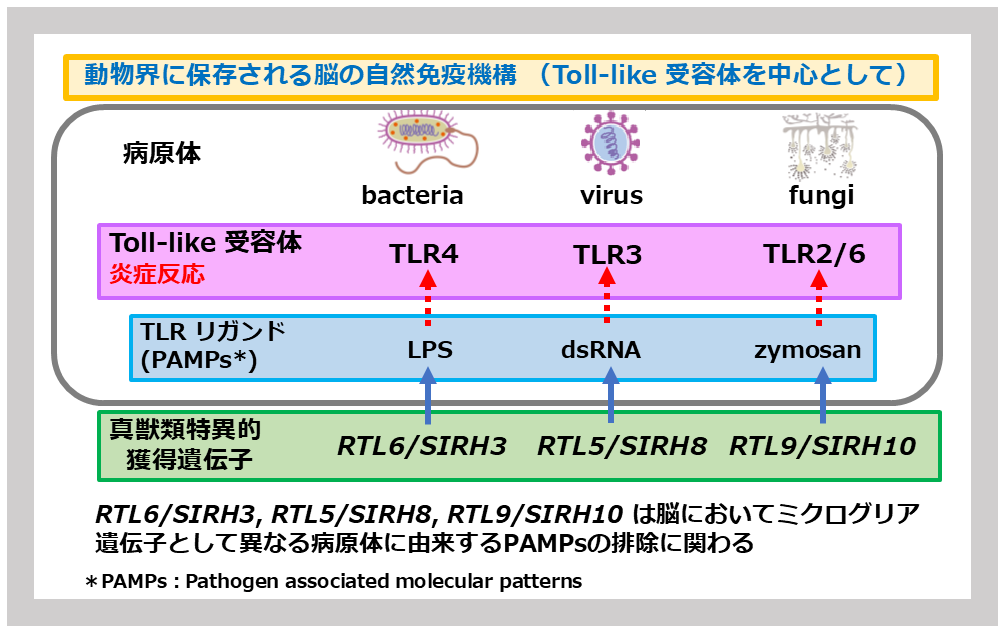
自然免疫は、動物界に広く保存される基本的な生体防御システムで、病原体など体に異物が侵入した時、マクロファージや好中球など貪食作用を持つ細胞がいち早く反応し排除する働きをしている。脳神経系ではミクログリアがこの役割を果たしている。幅広い異物に素早く対応できるのが特徴で、そのために複数のToll-like receptors (TLRs) が、それぞれに異物を特異的に認識して炎症反応を誘起する。これらの異物は、病原体関連分子パターン(Pathogen-associated molecular patterns: PAMPs)と呼ばれる病原体に固有の分子構造を通して認識される。グラム陰性細菌であれば細胞壁由来のリポポリサッカライド (LPS)、ウイルスであればdsRNAや非メチル化DNA、カビ(真菌)では細胞壁のザイモザンなどがPAMPsとして知られており、それぞれTLR7、TLR3、TLR2/6タンパク質に認識される(図26)。SIRH/RTL遺伝子群のうち、ミクログリアで特異的に発現する一群があり、3つが感染防御の最前線で、これらPAMPsの直接的な排除に機能していることがわかった(図26)。もう一つは、精神的ストレスに対応して機能していた。これらは、真獣類の脳を護る役目を果たしている大事な遺伝子と言えるだろう。
9-1 感染から脳を護る自然免疫の戦士Sirh3/Rtl6, Sirh8/Rtl5, Sirh10/Rtl9
(1) SIRH3/RTL6とSIRH8/RTL5
我々は、まずSIRH3/RTL6とSIRH8/RTL5の機能について調べた1。それはSIRH3/RTL6が真獣類の中で特に進化的保存性が高く、最も重要な機能があると考えられた遺伝子であり、SIRH8/RTL5はSIRH3/RTL6に最も近い構造をしていたからである((3)参照)。
SIRH3/RTL6とSIRH8/RTL5タンパク質の後ろに蛍光タンパク質(VenusやmCherry)を結合したノックイン(KI)マウスを使い、これらの融合タンパク質がミクログリアで作られ、分泌タンパクとして脳内に広く分布していることがわかった。そこにPAMPsであるLPSを投与すると、SIRH3/RTL6タンパク質は素早く反応してLPSとの複合体を作った(図27、図28)。
これにより、LPSの更なる拡散を防ぎ、この複合体がミクログリアへ取り込まれることで、LPSの速やかな分解が起こった。Sirh3ノックアウト(KO)マウスでは、このLPSの速やかな排除反応が起こらなかった。SIRH8/RTL5タンパク質もこのLPS複合体形成にも参加する
(図27)。
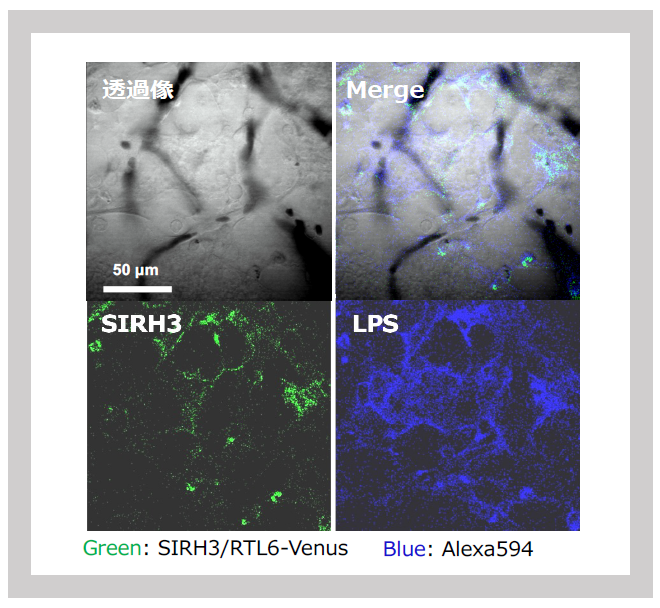
Green: SIRH3/RTL6-Venus, Red: LPS-Alexa594
3次元分割をした写真でSIRH3/RTL6タンパク質(緑)が複合体の中心部分(コア)に、LPS(赤)がその表面にトラップされているのがわかる。
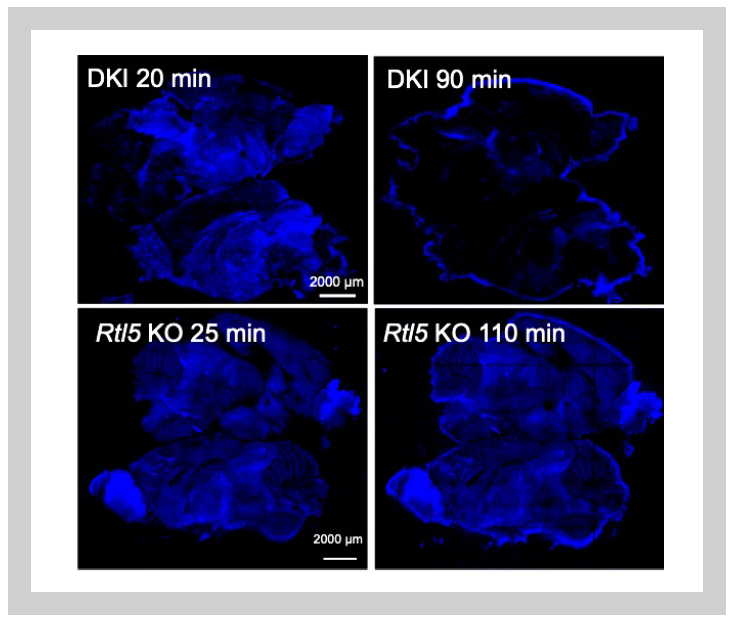
dsRNAの分解はDKI (Sirh3-Venus、Sirh8- Cherryの2つのノックインを同時に持つマウス)ではが進むが、Sirh8/Rtl5 KOでは残ってしまう。
Blue: dsRNA-Rhodamine
一方で、SIRH8/RTL5タンパク質は主としてウイルス由来のdsRNAや非メチル化DNAと特異的に複合体形成を行い、これらの排除に機能し、Sirh8 KOマウスではこの反応は起こらなかった(図29)。
すなわちSIRH3/RTL6とSIRH8/RTL5タンパク質は、脳内自然免疫の最前線でPAMPsを待ち構え、侵入すると素早く反応して排除に機能していることが明らかになった。この反応はTLRによる炎症反応の誘起と並行して進行すると思われる。これまでも、異物はミクログリアによって処理されると理解されていたが、この排除プロセスを効率よく進めるために特殊な機能を持つタンパク質が存在していたことが明らかになったのである。
SIRH3/RTL6とSIRH8/RTL5は、哺乳類の中でもヒトを含む真獣類というグループにのみしか存在しない遺伝子であるが、もともと病原体であるレトロウイルス由来の遺伝子から新しく作られた遺伝子が、「まるで将棋で取った駒のように(注1)」逆に病原体から宿主を守る役割を果たすために使われている。自然免疫機構はほとんどすべての動物が持つ進化的に保存された機構であるが、これらの遺伝子の存在が明らかになったことで、自然免疫機構も真獣類独自の進化を遂げていたことがわかる。他の動物でも、このようなPAMPsを直接的に排除する機構が存在するのでははないかと思われ、どのような遺伝子がそれを担っているのか、とても興味が持たれる。
- Irie M, Itoh J, Matsuzawa A, Ikawa M, Kiyonari H, Kihara M, Suzuki T, Hiraoka Y, Ishino F and Kaneko-Ishino T. Retrovirus-derived RTL5 and RTL6 genes are novel constituents of the innate immune system in the eutherian brain. Development 149: dev200976 (2022).
(2) SIRH10/RTL9
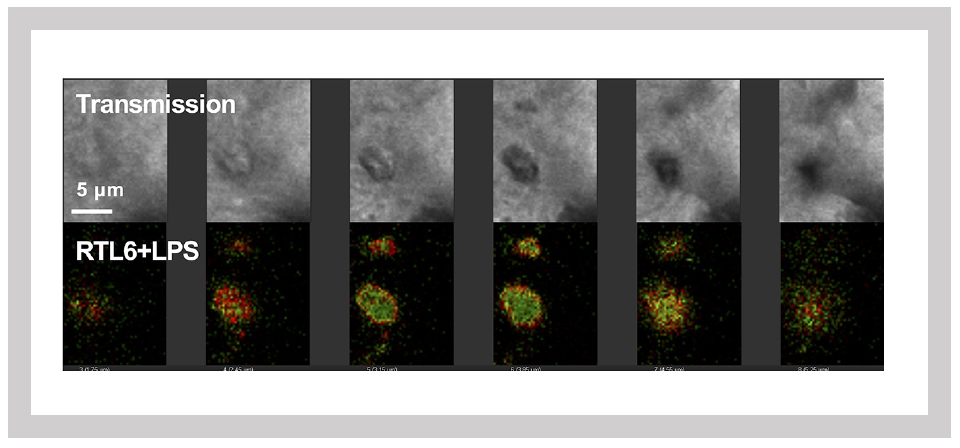
次に解析したのはSIRH10/RTL9である。SIRH10/RTL9タンパク質は、SIRH3/RTL6やSIRH8/RTL5とは異なり大きなタンパク質で、前半、中央部分はGAGとは全く無関係なアミノ酸配列(Herpes ウイルス由来のthe outer envelope glycoprotein BLLF1とthe large tegument protein UL36に相同性を示す2つの部分)からなっており、GAG由来の部分はC末側の1/3の部分に含まれている。我々はSIRH10/RTL9タンパク質の後ろに蛍光タンパク質mCherryを繋いだKIマウスを使って、その細胞内局在を調べたところ、SIRH10/RTL9タンパク質がミクログリアのリソゾーム内に局在することがわかった2(図30)。カビの細胞壁の成分であるザイモザンはミクログリアやマクロファージが素早く取り込んで、リソゾームに運ばれ、分解されることが報告されている。KIマウスの脳にザイモザンを投与したところ、リソゾーム内で、SIRH10/RTL9タンパク質とザイモザンが共局在することがわかった。SIRH10/RTL9タンパク質におけるGAG由来の部分の機能を知るために、GAGが存在するC末側の1/3の部分だけ欠損させたSirh10 KOマウスの脳にザイモザンを投与したところ、リソゾームに取り込むことはできたが、そこでの分解活性は失っていた(図31)。これにより、SIRH10/RTL9が取り込んだザイモザンの分解に関係していること、すなわちSIRH10/RTL9遺伝子はカビ(真菌)の感染から脳を守る機能を持つことがわかった。
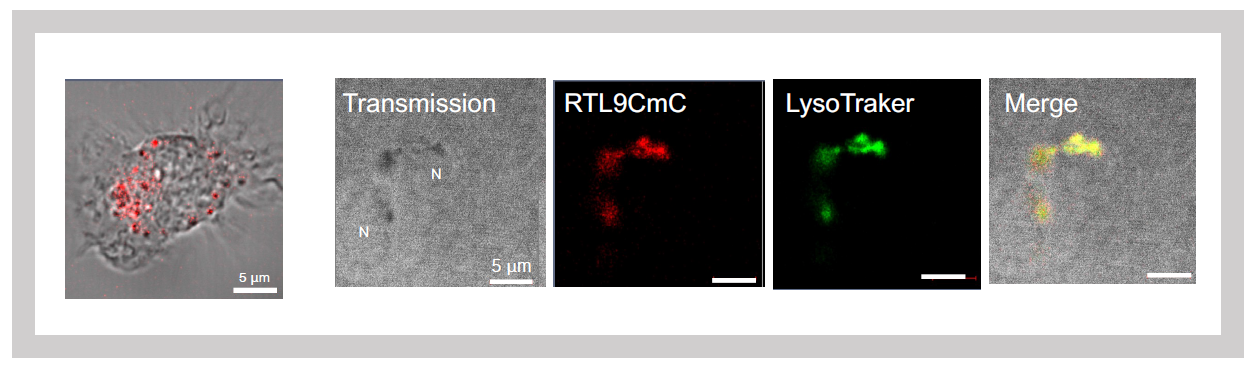
左:単離ミクログリアでのSIRH10/RTL9発現
右:SIRH10/RTL9シグナルはライソゾームを特異的に染色するLysoTrackerと一致する
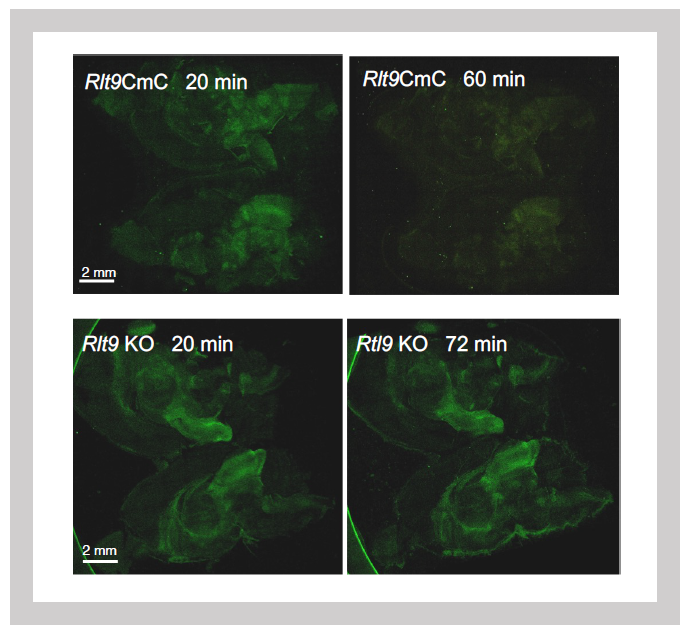
緑はザイモザンの蛍光シグナル
ザイモザンはSirh10/Rtl9-mCherryノックインマウスでは60分で処理される(上段)が、Sirh10/Rtl9 KOマウスでは72分後の処理されずに残る(下段)。」
- Ishino F, Itoh J, Irie M, Matsuzawa A, Naruse M, Suzuki T, Hiraoka Y and Kaneko-Ishino T. Retrovirus-derived RTL9 plays an important role in innate antifungal immunity in the eutherian brain. Int J Mol Sci 24:14884 (2023).
(3) SIRH3/RTL6タンパク質はどのようにして誕生したのか?
SIRH3/RTL6は非常に進化的保存性が高く、細胞の重要機能を持つ遺伝子群(ハウスキーピング遺伝子の平均)よりも高い進化保存性の値を示す(表1)。これは、真獣類において、細菌感染から脳を守ることがどれほど重要なことであったか、その必要性の高さを意味していると考えられる。
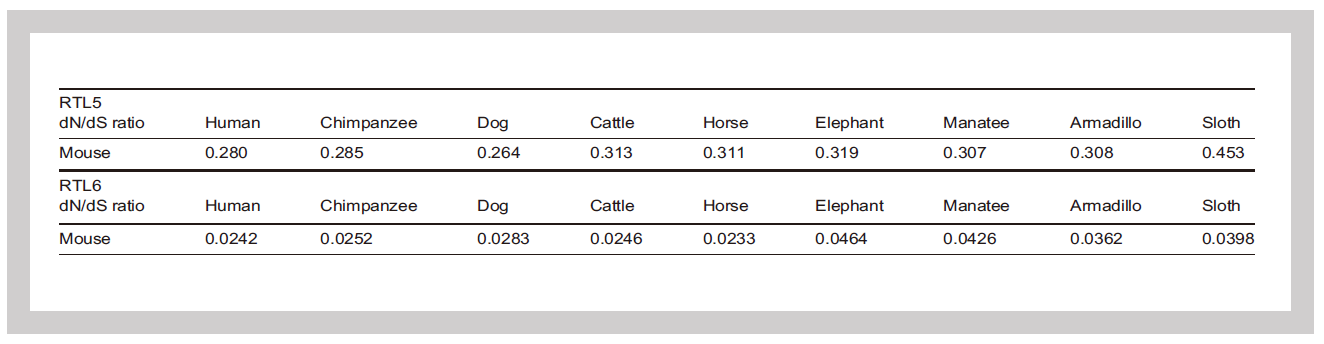
dN/dSは遺伝子がコードするタンパク質のアミノ酸の同義置換(S)、非同義置換(N)の率を計算した値で、1より小さければ保存性が高いと評価する。ハウスキーキング遺伝子の平均は∼0.093、最も保存性の高い Histone H3 遺伝子は <0.01であり、SIRH3/RTL6は非常に保存性が高く、重要な機能を持っていることが示唆される。
SIRH3/RTL6タンパク質の特徴として、等電点(pI)が11.15という極塩基性のタンパク質であることが挙げられる。元になったGAGタンパク質とは、アミノ酸配列レベルで27.7%のidentity (44.1 % similarity) なので、かなり大きく性質を変化させたといえる。N末側にはロイシンジッパー構造、C末側には極塩基性の元となる塩基性アミノ酸が連続したクラスター (pI=12.0)が存在する。この構造は、SIRH3/RTL6タンパク質が複合体を形成する相手であるLPSが極酸性物質(pI=2.0)であることを考えると納得がいく。すなわち、LPSを効果的に結合できる新しいタンパク質へと変化したことが推測される。
元々、ウイルスのGAGタンパク質はPOLプロテアーゼによって3つに分解され、ウイルスの形を作るマトリックス、RNAゲノムを収納するキャプシド、RNAゲノムと結合するヌクレトキャプシドとして機能する。特に、SIRH3/RTL6タンパク質を構成するキャプシド相同部分は、自己集合性を示す性質を持っている。これにC末の極塩基性のヘリックス構造を持つことでLPSを捕まえ易い構造となっている。しかも、N末側のロイシンジッパー構造はさらに2~多量体を作る性質が強化されていると予想される(図32)。実際に、複合体を観察すると、SIRH3タンパク質をコアとして表面にLPSを結合した像が見られている。このようにアミノ酸配列構造を考察すると、SIRH3/RTL6タンパク質がLPSを効率よく結合し、排除するための構造をしていることがわかる。
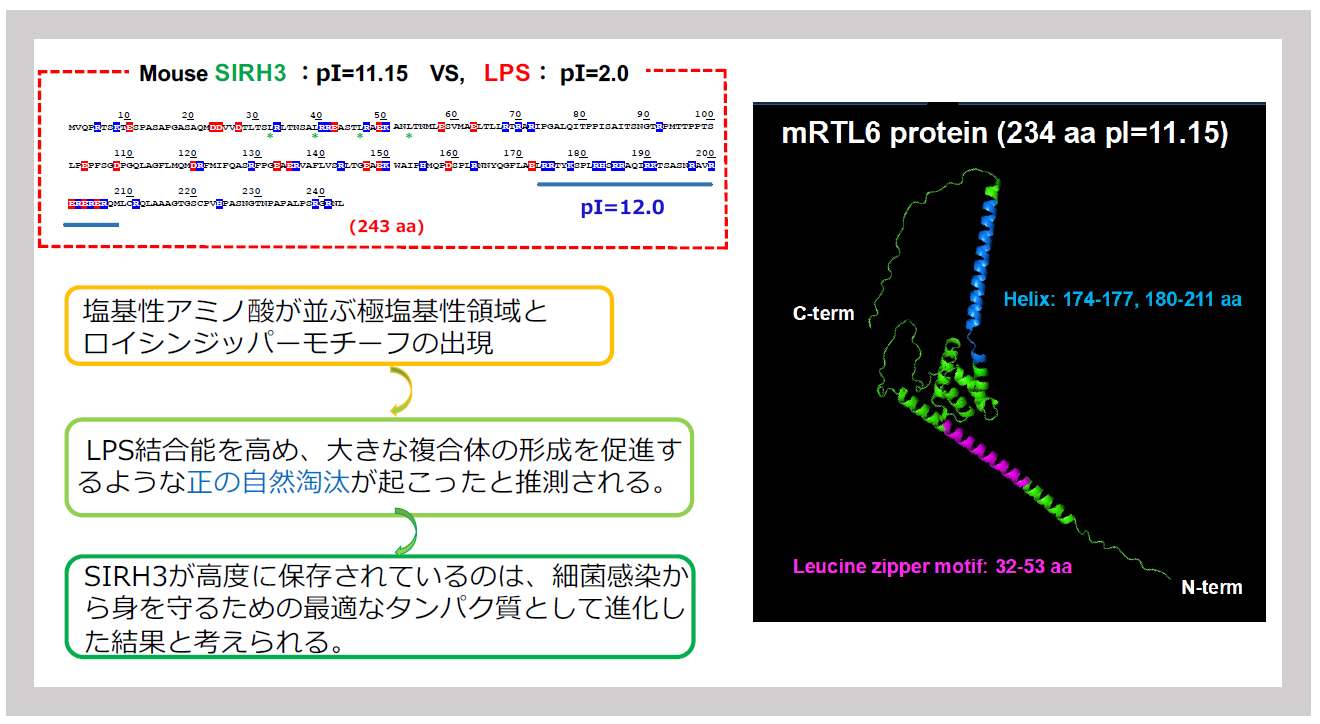
左はアミノ酸配列でロイシンジッパー構造と塩基性配列の並ぶ構造の位置を示している。
このような、ロイシンジッパー構造の出現や、より塩基性をもつ配列への変化が、仮に突然変異の蓄積だけで生じたとすれば、非常に多くの突然変異が必要とされる。ウイルス由来遺伝子の哺乳類ゲノムへの内在化から、細菌感染対応に適合した新しい遺伝子の誕生までには、かなりの年月がかかったことが想定される。こう考えると、この遺伝子の誕生は、次第により適応した遺伝子となるために数多くの自然選択の過程を経た、ダーウィン的進化の好例となると考えられる。
注1 将棋では取った相手の駒も自分の駒として必要な時に使える。この「駒をもう一度使えるというルールは、日本の将棋だけがもつ大きな特徴である。また敵陣に入った場合には、“成った駒”(裏返して別の文字に変わる)としてパワーアップした駒として使うこともできる。SIRH遺伝子は獲得したウイルス遺伝子に変異を加えてパワーアップしたものを使っているので、将棋の駒のように使ったと言えるかも知れない。
9-2 ストレスから脳を守る自然免疫の戦士Sirh11/Rtl4
我々は2015年に、Sirh11/Zcchc16 (Rtl4) KOマウスが、衝動性が高まり、短期記憶力や新規環境への適応力が落ちること、大脳皮質においてノルアドレナリン(NA)の回復が遅れることを報告した3(スピンオフ5)。ヒトZCCHC16遺伝子は、自閉症スペクトラム症の患者において希ではあるが変異があることが報告されている4-6。このような重要性にもかかわらず、Sirh11/Zcchc16遺伝子は、脳における
発現量が非常に少ないため、発生のいつ、どこで、どの細胞(神経細胞かグリア細胞か?)で発現するのか、そしてNA刺激に対してどのように振る舞うのか?など重要な問題は長らく残されたままであった。
そこで、SIRH11/RTL4タンパク質の後ろに蛍光タンパク質Venusを繋いだKIマウスを使って脳内での発現を可視化し、その分布とNAとの関係性を調べてみた(Ishino et al. Int J Mol Sci 2024)。SIRH11/RTL4CVタンパク質は、出生後10日目あたりから脳内の視床下部、中脳、海馬、扁桃体に分泌タンパク質として小さなドットとして強いシグナルが観察された。2〜3週間目まではシグナル強度は増加傾向にあり、その後は、少し少ないレベルで発現は継続した。出生直後は、全体としてのシグナル強度は少ないものの、視床の周辺部、中脳水道、海馬あたりなど局部的には強い1μmぐらいの顆粒として検出された7。
視床下部、中脳でのシグナル強度は、マウスへの刺激に非常に敏感に応答し、飼育室から実験室に運搬する刺激だけで増加した。また、βアドレナリン受容体を介したNAの作動薬であるイソプロテレノールの投与によっても有意に増加した(図33)。一方で、イソフルラン麻酔下では、5分でシグナル強度は低下すること、その際にNAとセトロニンの再取り込み阻害剤であるミルナシプランを投与しておくと、シグナル強度は保たれることがわかった7(図34)。
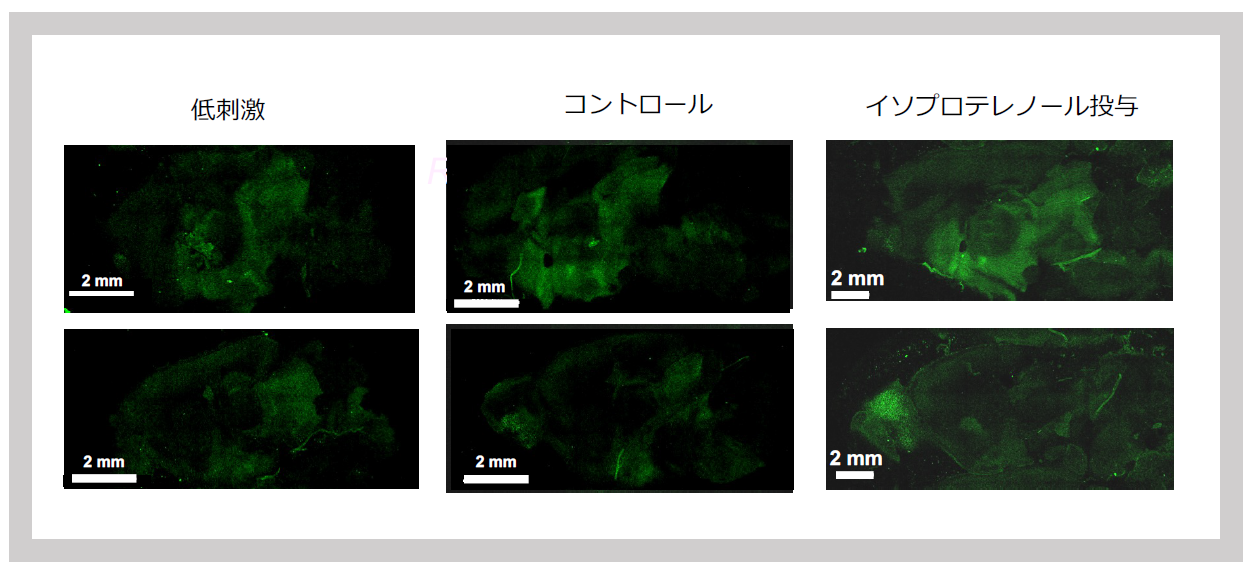
SIRH11のシグナルは飼育室(左)から実験室(中央)に運ぶだけで増大し、NAの作用を真似るイソプロテレノールの投与でさらに増大する。
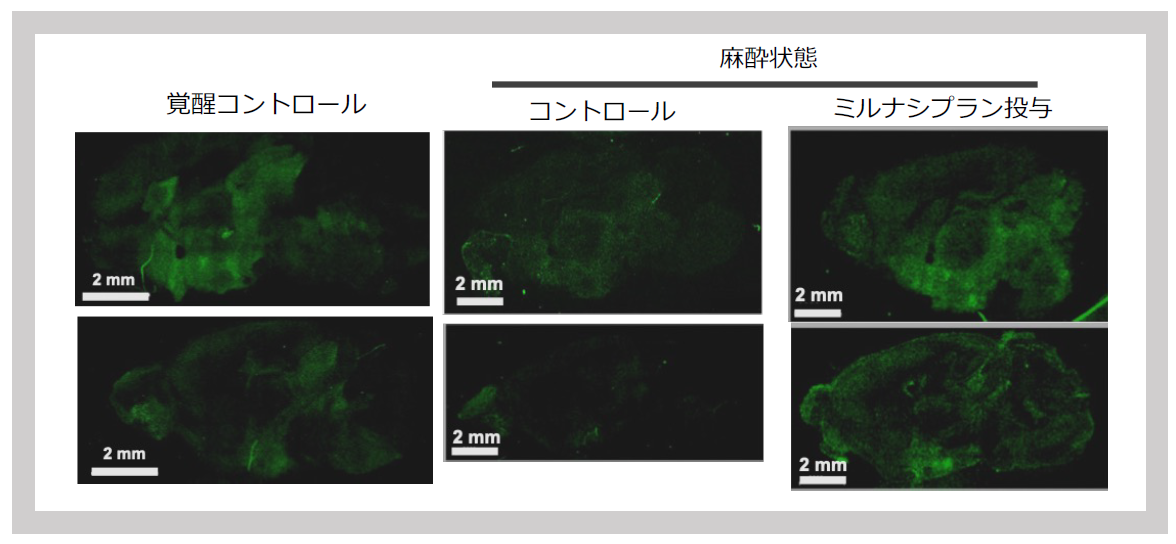
SIRH11シグナルは実験室にいる状態(左)で、麻酔を5分かけると著しく減少する(中央)が、麻酔時にセロトニン・ノルアドレナリン取込み阻害剤のミルナシプランを投与するといつまでもシグナルが残る。
細胞内に分泌タンパク質として存在することから、SIRH3/RTL6、SIRH8/RTL5タンパク質と同様、ミクログリアでの発現が予想されたため、ミクログリアとアストロサイトの共培養系で調べてみると、ミクログリア特異的にシグナルが観察され(図35)、イソプロテレノール添加によって、ミクログリアから培地中へシグナルが放出する過程も捉えることができた。このようにSIRH11/RTL4タンパク質はミクログリアで発現し、NA刺激によって細胞外に放出されることが明らかとなった7。脳での観察でも蛍光強度が、ストレスなどのNA関連シグナルによって増加すること、また覚醒状態に依存し、放出されたNAの存在によって安定化されることなど、このタンパク質とNAを介したストレス応答に関与していることが明らかとなった。
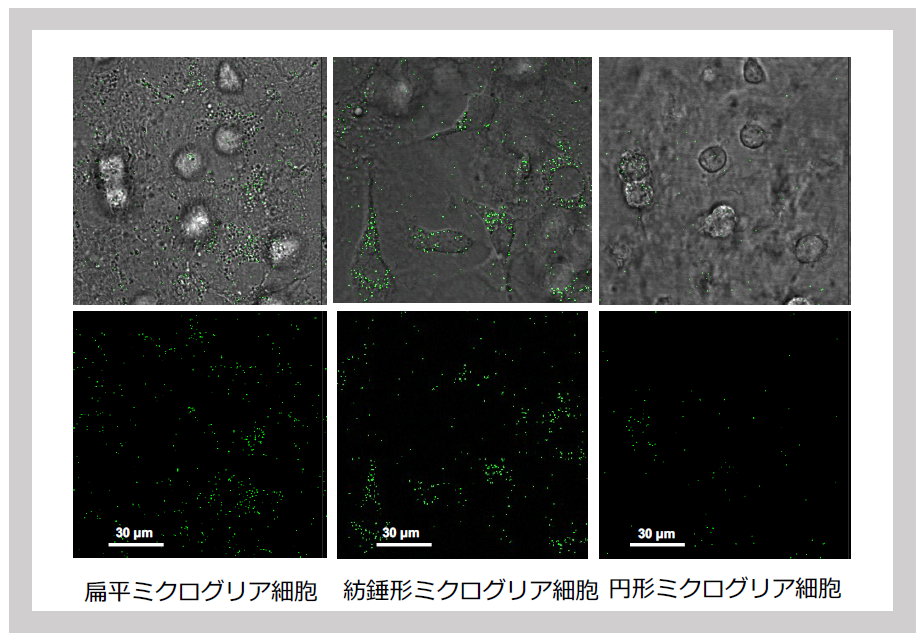
新生児脳から混合グリア培養を行うと、アストロサイトのフィーダ細胞の内部に生育する扁平ミクログリア(左)、フィーダ細胞上に紡錘形ミクログリア(中央)、さらに培地中に浮遊する円形ミクログリア(右)にSIRH11のシグナルが観察される。
一方で、発現時期は、新生児が生まれてから新しい環境に適応するためのNA神経ネットワーク形成に関わる場所と時期と一致しており、このタンパク質の分泌が新しい刺激に適応した正常な脳神経系の発達に重要な役割を果たしている可能性が高いと考えられる。Sirh11/Zcchc16 (Rtl4) KOマウスでは、この過程に支障をきたすため、それがASDの発症につながると考えられた。また、NAは神経細胞をはじめ多様な細胞にアポトーシスを誘導することが知られている。生物の生存に必須であるが毒性もあるNAから細胞(ミクログリア)を守るために機能をしている可能性や、アポトーシスを起こした細胞断片を処理するために機能している可能性があると考えている。すなわち、病原菌感染から脳を守る上記の3つの遺伝子とは異なり、SIRH11/RTL4は精神的ストレスに対応する役割を持っていると考えられる。この遺伝子を獲得したことで、真獣類はNAシグナルを安全に効率よく利用できるようになったのではないだろうか7
- Irie M, Yoshikawa M, Ono R, Iwafune H, Furuse T, Yamada I, Wakana S, Yamashita Y, Abe T, Ishino F and Kaneko-Ishino T. Cognitive function related to the Sirh11/Zcchc16 gene acquired from an LTR retrotransposon in eutherians. PLoS Genet 11, e1005521 (2015).
- Lim ET, Raychaudhuri S, Sanders SJ, Stevens C, Sabo A, MacArthur DG, Neale BM, Kirby A, Ruderfer DM, Fromer M et al. Rare complete knockouts in humans: Population distribution and significant role in autism spectrum disorders. Neuron 77, 235–242 (2013).
- Boles RG. (University of California School of Medicine, Irvine, CA, USA). Boy with autism and frameshift variant in ZCCHC16. Personal communication (2017).
- Fernández-Jaén, A. (Universidad Europea de Madrid, Madrid, Spain). ZCCHC16 mutation, intellectual disability and autism. Personal communication (2021).
- Ishino F, Itoh J, Matsuzawa A, Irie M, Suzuki To, Hiraoka Y, Yoshikawa M and Kaneko-Ishino T. RTL4, a retrovirus-derived gene implicated in autism spectrum disorder, is a microglial gene that responds to noradrenaline in the postnatal brain. Int J Mol Sci 26: 13738 (2024).
10. 胎盤は進化の実験場 ―胎盤形成におけるウイルスからの遺伝子獲得の重要性―
ここまで、PEG10が胎盤の初期形成に1(ヘッドライン4)、PEG11/RTL1が胎盤内の胎児毛細血管の維持に2(ヘッドライン5)、そしてSirh7/Ldoc1が胎盤の内分泌制御に機能3(ヘッドライン5)することで、この3つの獲得遺伝子が、胎児や新生児の生存に必須な機能を果たしていることを紹介してきた。その後の解析で、PEG10にはさらに胎児毛細血管の形成と維持に関わることがわかってきた。
PEG10には、ウイルス由来の特徴がいくつか保存されている(補足参照)が、そのうちの一つがPOL部分にあるDSGモチーフを持つプロテアーゼである。DSGはアスパラギン酸(D)-セリン(S)-グリシン(G)の三つのアミノ酸を表していて活性中心を形成している。特にアスパラギン酸(D)が直接、プロテアーゼ機能を発揮するアミノ酸である。この構造は高度に保存されているため、胎盤形成に必須な役割を果たしていると考えていたが、それを不活性アミノ酸であるアラニン(A)に変換したPEG10-ASG変異体を作ってみると、予想外に胎盤は形成されて、胎児も育った。しかし、その胎児は出産の前後(周産期)に胎盤機能の不全により、全て死んでしまった(図36)。胎盤を見ると胎児毛細血管全体構造が壊れていて、PEG11 KOの場合とは異なっていた4。PEG10のもう一つのウイルス由来の特徴は、GAGとPOLに由来するORF1とORF2があることで、ORF1タンパク質とORF1-ORF2の融合タンパク質の2種類のタンパク質を産生する。このうちORF1だけを作れないようにした変異体は、胎児期中期で致死になる(志浦ら 投稿準備中)。これも胎盤の異常が関係しており、PEG10は胎盤形成の初期から出産までの妊娠の全期間を通して、胎盤機能に関係しているマルチファンクショナルで重要な胎盤遺伝子であると言える。
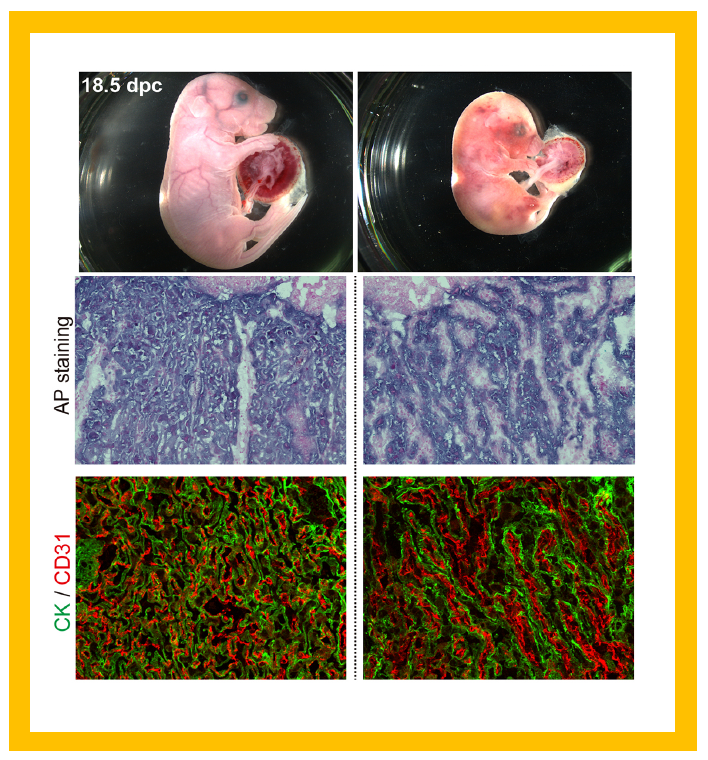
この変異体マウスは出産直前、直後の周産期で致死性を示す(上段)。原因は 胎盤の胎児毛細血管のラビリンス層にあり、アルカリンホスファターゼ染色(AP staining:中段)やサイトケラチン染色(CK:下段)で染めたトロホブラスト細胞が融合してしまっている。その内部の血管内皮細胞も同様に融合してしまっていて、胎児毛細血管全体が破壊されている。
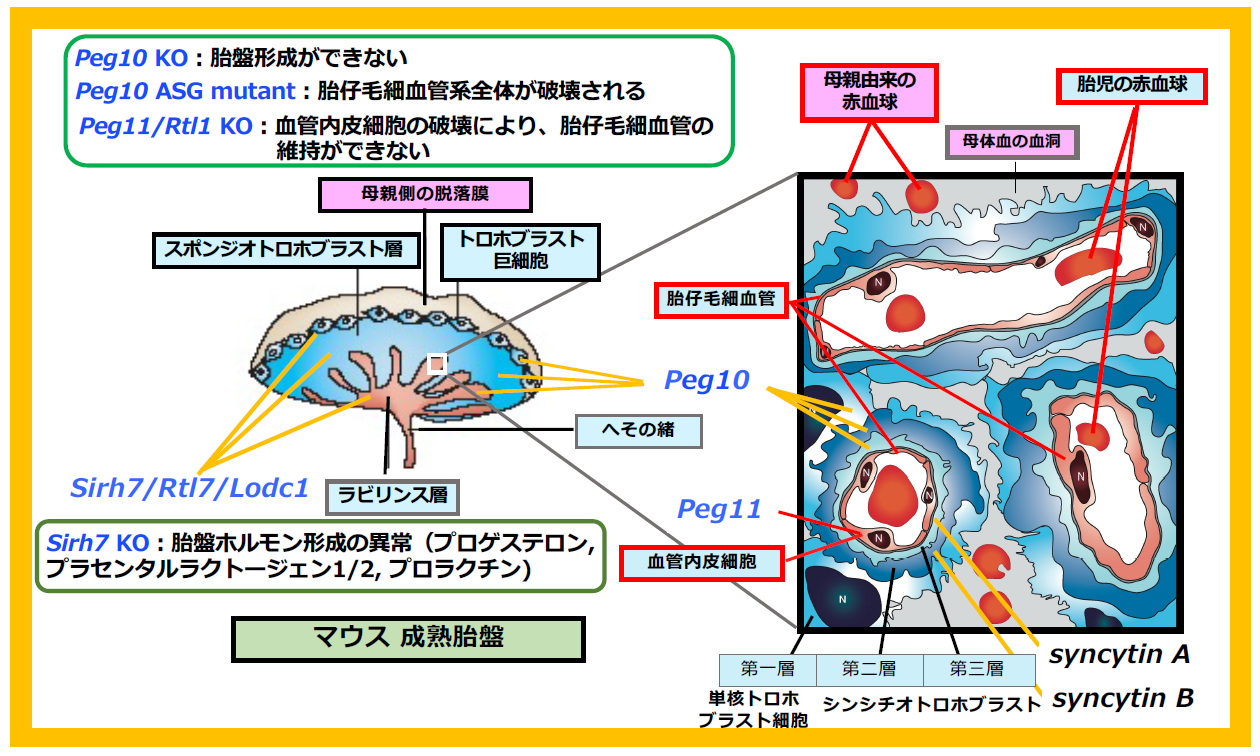
胎盤で必須な機能を果たすウイルス由来の獲得遺伝子を一つの図にまとめると図37になる。PEG10は胎盤の3種類のトロホブラスト細胞で発現している。Peg10 KOはスポンジオトロホブラストとラビリンス層が形成できず初期胚致死に、PEG10-ASG変異体ではラビリンス層の胎児毛細血管維持ができずに周産期致死になる。一方で、PEG11/RTL1は胎児毛細血管内皮細胞で発現し、Peg11/Rtl1 KOでは内皮細胞が破壊され胎児期後期致死となる。Sirh7/Ldoc1はPEG10同様、全てのトロホブラスト細胞で発現し、形態的には胎盤の3層構造に乱れ、機能的には胎盤で形成されるプロゲステロン(P4)、プラセンタルラクトーゲン1・2や多数のプロラクチンなどのホルモンの産生に異常を生じる。そのため、分娩のタイミングが遅延し、母親の子育て不全により新生児が致死となる(ヘッドライン5、図13参照)。このように、どの遺伝子も胎盤での発現部位の異常が、胎児・新生児致死に繋がっていることがわかる。
これらに加え、胎盤では2つのシンシチン遺伝子(syncytin A, B)が胎児毛細血管の内側2層のシンシチオトロホブラスト細胞の融合反応に必須な機能を果たしている5,6。シンシチン遺伝子は、ウイルスの感染に必要なENVタンパク質の細胞融合能をそのまま利用したと考えられている。真獣類に共通するSIRH/RTL遺伝子とは対照的に、シンシチンは真獣類の系統ごとに異なるウイルスから独立に獲得された遺伝子で、ヒトではマウスとは別の2つのシンシチン(syncytin 1, 2)が機能している7,8。
このように、胎盤では少なくとも5つのウイルス由来の獲得遺伝子が必須の機能を果たしているという事実は、真獣類が胎盤という新しい臓器を誕生させるために、“ウイルスからの新たな遺伝子獲得”が非常に重要な役割を果たした証拠となると考える。
補足
PEG10に残るウイルスの特徴
レトロウイルスはGAG、POL、ENVの3つのタンパク質をコードしている。
GAGはPOLに含まれるプロテアーゼにより分解し、ウイルス粒子の外側を構成するマトリクス、RNAゲノムを包見込むキャプシド、RNAゲノムをコンパクトにまとめるヌクレオキャプシドの3つの構造タンパク質を作る。このようにGAGにはウイルス構造を作るのに必要なすべてのタンパク質が含まれる。
POLは、上述のプロテアーゼ以外に、逆転写酵素(RT)、RNA分解酵素H (RNaseH)、DNAインテグラーゼ(INT)が含まれ、プロテアーゼによって切り出され、ウイルスのRNAゲノムから2本鎖DNAを作り出す。POLには、宿主ゲノムへ挿入するまでの全行程に必要な酵素の全てが揃っているのである。
ENVはウイルスが宿主の細胞の細胞膜に融合するための必要な酵素活性を持つ。
PEG10にはレトロウイルスがもつ性質のいくつかが残されている。
- GAGとPOLに由来する2つのORF(ORF1とORF2)を持ち、ORF1が単独で読まれるだけでなく、「-1フレームシフト機構」によりORF1-ORF1がひとつながりのタンパク質となる。こうして、PEG10には2種類のタンパク質が生成される。
- GAGに相当するORF1のC末にRNA結合ドメイン (CCHC)が存在する。
- POLに相当するORF2の初めにあるプロテアーゼドメイン (DSG)が存在する。
このようにPEG10からはORF1とORF1-ORF2の2種類のタンパク質が作られるが、さらにPOLのプロテアーゼ活性により、幾つかの断片に分解される。そのため、それぞれの部分が異なる機能を持つ可能性が考えられる。
ここで、2種類の獲得遺伝子(Acquired genesとCaptured genes)についても考察しておきたい。PEG10、PEG11/RTL1, SIRH3/LDOC1を含むSIRH/RTL遺伝子と、シンシチン遺伝子の両方を“ウイルス由来の獲得遺伝子”として紹介したが、日本語では同じ獲得遺伝子でも、英語ではAcquired geneとCaptured geneと使い分けている。これは遺伝子の獲得された経緯を表している。
シンシチン遺伝子はウイルスのENV遺伝子を獲得した際に、ほぼそのままの形で胎盤のシンシチオトロホブラスト細胞の形成(融合)に用いている。そのため、新しく内在化したウイルスのENVが機能的により適していた場合、それに機能をバトンパスして遺伝子が入れ替わってきた可能性が高い9,10。まさに、捕獲(Capture)したウイルスの遺伝子の流用・転用 (co-option) と言える。
一方、SIRH/RTL遺伝子はGAGやPOL遺伝子を元にしているが、変異によってアミノ酸配列の類似性は20〜30%に低下しており、全く新しい遺伝子へと変化している。SIRH3タンパク質のところで説明したように(ヘッドライン9、図32)、GAGの自己集合体を作りやすい性質を利用しながら、変異によって新たな機能を持つタンパク質となっている。また、PEG10やPEG11/RTL1も、変異によりウイルスとは異なる新機能を獲得したことで、哺乳類の胎生を支えるタンパク質となっている(ヘッドライン5、7、10)。つまり、Acquired genesは、長い時間をかけて作り変え、個体にとって有利な新形質となった遺伝子なのである。
SIRH/RTL遺伝子群には、SIRH3/RTL6, SIRH8/RTL5, SIRH10/RTL9, SIRH11/RTL4のようにミクログリアで発現し、脳の自然免疫に機能するグループが存在している。これらは、胎盤で機能するグループとどのような関係があるのか、そしてどのようにウイルスから遺伝子が獲得されたのだろうか。ミクログリアは普通の免疫細胞のように骨髄から形成されるのではなく、発生の初期(骨髄が形成されていない時期)に、卵黄嚢で発生し胎児の脳に移動して、一生の間、脳で機能する11。卵黄嚢は胎盤と同じ、胚体外組織であるという共通項がある(図38)。これは胚体外組織が遺伝子獲得の場として機能している可能性を示唆する。
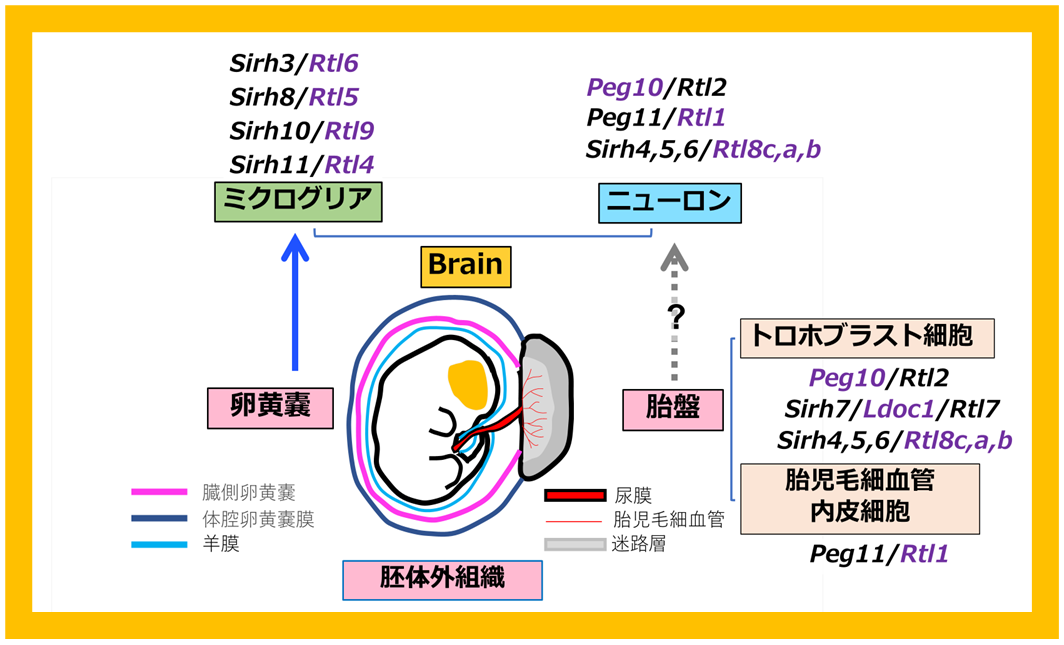
内在性レトロウイルス(ERV)やトランスポゾンは胚(胎児)では、高レベルのDNAメチル化で発現が完全に抑制されているが、胚体外組織は低メチル化であり、これらの遺伝子がわずかに発現可能である。最初にPEG10が尿膜(胎盤の元になる胚体外組織)で獲得され胎盤が誕生すると、次は胎盤がさらなるウイルスからの遺伝子獲得の場として利用され、哺乳類の進化を促進する効果をもたらした可能性を指摘しておきたい。その意味で、「胎盤・卵黄嚢は哺乳類進化の実験場」と言えるだろう。
SIRH/RTL遺伝子群は真獣類には11個存在するが、卵黄嚢胎盤を持つ有袋類ではPEG10とSIRH12の2個のみであり12、真獣類になって獲得されたもう一つのウイルス由来PNMA遺伝子群も、真獣類では12~15存在するが、有袋類では遺伝子として存在するのは1個のみで13、明らかに真獣類の方が有袋類より、遺伝子獲得の確率が高くなっていることがわかる。脊椎動物全体を見渡しても、内在性レトロウイルス/LTRレトロトランスポゾンは、脊椎動物全体の種に大量に含まれているが(ヒトでは全ゲノムの9 %)、これらが遺伝子化された可能性は非常に低く、現存する例の大部分は哺乳類の系統で起きている14。このデータも、我々の「胎盤・卵黄嚢は哺乳類進化の実験場」仮説を支持している。
真核生物全体で見ればLTRレトロトランスポゾン(現在はレトロウイルス様LTRレトロトランスポゾン Metaviridaeというグループにまとめられている)からの遺伝子獲得も非常に少ないが、哺乳類(真獣類)と被子植物に集中している15。被子植物は次の世代となる種子を子房(めしべの下部)の中に宿す生物群であり、面白いことに、哺乳類と同様にゲノムインプリンティング機構を保有している。新たな遺伝子獲得というイベントの発生頻度にゲノムインプリンティング機構が関係するのかどうか、今後の展開を期待したい。
- Ono R, Nakamura K, Inoue K, Naruse M, Usami T, Wakisaka-Saito N, Hino T, Suzuki-Migishima R, Ogonuki N, Miki H, Kohda T, Ogura A, Yokoyama M, Kaneko-Ishino T, and Ishino F. Deletion of Peg10, an imprinted gene acquired from a retrotransposon, causes early embryonic lethality. Nat Genet 38, 101–106 (2006).
- Sekita Y, Wagatsuma H, Nakamura K, Ono R, Kagami M, Wakisaka-Saito N, Hino T, Suzuki-Migishima R, Kohda T, Ogura A, Ogata T, Yokoyama M, Kaneko-Ishino T* and Ishino F*. Role of retrotransposon-derived imprinted gene, Rtl1, in the feto-maternal interface of mouse placenta. Nat Genet 40, 243–248 (2008).
- Naruse M, Ono R, Irie M, Nakamura K, Furuse T, Hino T, Oda K, Kashimura M, Yamada I, Wakana S, Yokoyama M, Ishino F, Kaneko-Ishino T. Sirh7/Ldoc1 knockout mice exhibit placental P4 overproduction and delayed parturition. Development 141, 4763–4771 (2014).
- Shiura H, Ono R, Tachibana S, Kohda T, Kaneko-Ishino T* and Ishino F*. PEG10 viral aspartic protease domain is essential for the maintenance of fetal capillary structure in the mouse placenta. Development 148:dev199564 (2021).
- Dupressoir A, Vernochet C, Bawa O, Harper F, Pierron G, Opolon P, Heidmann T. Syncytin-A knockout mice demonstrate the critical role in placentation of a fusogenic, endogenous retrovirus-derived, envelope gene. Proc Natl Acad Sci U S A. 106,12127–12132 (2009).
- Dupressoir A, Vernochet C, Harper F, Guégan J, Dessen P, Pierron G, Heidmann T. A pair of co-opted retroviral envelope syncytin genes is required for formation of the two-layered murine placental syncytiotrophoblast. Proc Natl Acad Sci U S A. 108, E1164–1173 (2011).
- Mi S, Lee X, Li X, Veldman GM, Finnerty H, Racie L, LaVallie E, Tang XY, Edouard P, Howes S, Keith JC Jr, McCoy JM. Syncytin is a captive retroviral envelope protein involved in human placental morphogenesis. Nature 403, 785–789 (2000).
- Blaise S, de Parseval N, Bénit L, Heidmann T. Genomewide screening for fusogenic human endogenous retrovirus envelopes identifies syncytin 2, a gene conserved on primate evolution. Proc Natl Acad Sci U S A 100, 13013–13018 (2003).
- Lavialle C, Cornelis G, Dupressoir A, Esnault C, Heidmann O, Vernochet C, Heidmann T. Paleovirology of 'syncytins', retroviral env genes exapted for a role in placentation. Philos Trans R Soc Lond B Biol Sci 368:20120507 (2013).
- Imakawa K, Nakagawa S, Miyazawa T. Baton pass hypothesis: successive incorporation of unconserved endogenous retroviral genes for placentation during mammalian evolution. Genes Cells 20, 771–788 (2015).
- Ginhoux F, Greter M, Leboeuf M, Nandi S, See P, Gokhan S, Mehler MF, Conway SJ, Ng LG, Stanley ER, Samokhvalov IM, Merad M. Fate mapping analysis reveals that adult microglia derive from primitive macrophages. Science 330, 841–845 (2010).
- Ono R, Kuroki Y, Naruse M, Ishii M, Iwasaki S, Toyoda A, Fujiyama A, Shaw G, Renfree M B, Kaneko-Ishino T and Ishino F. Identification of SIRH12, a retrotransposon-derived gene specific to marsupial mammals. DNA Res 18, 211–219 (2011).
- Iwasaki S, Suzuki S, Clark H, Ono R, Shaw G, Renfree M B, Kaneko-Ishino T and Ishino F. Identification of novel PNMA-MS1 in marsupials suggests LTR retrotransposon-derived PNMA genes differently expanded in marsupials and eutherians. DNA Res 20, 425–436 (2013).
- Wang J, Han GZ. Frequent Retroviral Gene Co-option during the Evolution of Vertebrates. Mol Biol Evol 37, 3232–3242 (2020).
- Wang J, Han GZ. Unearthing LTR Retrotransposon gag Genes Co-opted in the Deep Evolution of Eukaryotes. Mol Biol Evol 38, 3267–3278 (2021).

